��Ŀ����
����Ŀ��������ѧ֪ʶ���
��1���ء��������Ԫ�صĻ�����������������̫���ܵ�ص���Ҫ���ϣ���֪��SeO2�ڳ������ǰ�ɫ�ľ��壬�۵�Ϊ340��350�棬��SeO2�����������壬SeO2��Seԭ�Ӳ�ȡ���ӻ�����Ϊ
��2��±�ص��ʼ��仯�����ڹ�ũҵ�����������ж�����Ҫ����;��
��ͬ����Ԫ�صĵ縺�Դ�С����һ���Ĺ��ɣ�±��Ԫ�أ�F��Cl��Br��I���У��縺����С���� �� ��̬Brԭ�ӵļ۵����Ų�Ϊ ��
����Ԫ�ؾ���ȱ�����ԣ��۵��������ڼ۲����������仯���������й¶Ե��ӵķ��ӻ���������������BF3����NH3��Ӧ����BF3NH3 �� BF3���ӵķ��ӹ���Ϊ �� BF3NH3��BF3��NH3֮��ͨ�����������Ӽ���������λ���������������
��3��ij�����ǿ���ҩ���е�����Ԫ�أ��侧���н���ԭ�ӵĶѻ���ʽ��ͼ��ʾ���þ����н���ԭ�ӵ���λ��Ϊ �� ����֪������Ħ������ΪMg/mol��ԭ�Ӱ뾶Ϊrpm�������ӵ�����ΪNA �� ��þ������ܶ�Ϊg/cm3 �� ���ú�M��NA����Ĵ���ʽ��ʾ��1pm=1.0X10��10cm�� 
���𰸡�
��1�����Ӿ��壻sp2�ӻ�
��2��I��4s24p5��ƽ���������Σ���λ��
��3��12
���������⣺��1��SeO2�����°�ɫ���壬�۵�Ϊ340��350�棬�۵�ͣ�Ϊ���Ӿ��壻SeO2������Seԭ�Ӽ۲���Ӷ�=2+ ![]() ��6��2��2��=3��Seԭ�ӵ��ӻ�����Ϊsp2�ӻ���
��6��2��2��=3��Seԭ�ӵ��ӻ�����Ϊsp2�ӻ���
���Դ��ǣ����Ӿ��壻sp2�ӻ�����2����ͬ�������϶��µ縺�Լ�С����F�ĵ縺�����I�ĵ縺����С��Brԭ�ӵĺ�������Ų�ʽΪ��[Ar]3d104s24p5 �� �����7������Ϊ�۵��ӣ����Ի�̬Brԭ�ӵļ۵����Ų�Ϊ4s24p5 ��
���Դ��ǣ�I��4s24p5�� ��BF3�����м۲���ӶԸ���=3+ ![]() ����3��3��1��=3�Ҳ����µ��Ӷԣ����Ը÷�����ƽ�������νṹ��������BF3NH3�У�Bԭ���ṩ�չ����ԭ�ӡ�Nԭ���ṩ�µ��Ӷԣ�����B��Nԭ��֮���γ���λ����
����3��3��1��=3�Ҳ����µ��Ӷԣ����Ը÷�����ƽ�������νṹ��������BF3NH3�У�Bԭ���ṩ�չ����ԭ�ӡ�Nԭ���ṩ�µ��Ӷԣ�����B��Nԭ��֮���γ���λ����
���Դ��ǣ�ƽ���������Σ���λ������3���ɾ���ͼ��֪���þ�����ԭ�ӵĶѻ���ʽΪ�����������ܶѻ�������λ��Ϊ12������߳�Ϊacm����a2+a2=��4r��10��10��2 �� V=a3=��2 ![]() r��10��10��3 �� ������ԭ����Ϊ
r��10��10��3 �� ������ԭ����Ϊ ![]() ��6+
��6+ ![]() ��8=4������������Ϊm=
��8=4������������Ϊm= ![]() �����Ԧ�=
�����Ԧ�= ![]() =
= 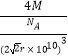 ��
��
���Դ��ǣ�12��  ��
��

