题目内容
【题目】甲、乙两杯醋酸稀溶液,甲的pH=a,乙的pH=a+1,对下列叙述的判断正确的是( )
A.甲中水电离出来的H+的物质的量浓度是乙中水电离出来H+的物质的量浓度的10倍
B.中和等物质的量的NaOH溶液需甲、乙两杯醋酸溶液的体积,10V(甲)>V(乙)
C.物质的量浓度c(甲)>10c(乙)
D.甲中的c(OH-)为乙中的c(OH-)的10倍
【答案】C
【解析】
A.c(H+)=10-pH,所以c (H+)甲=10-a,c (H+)乙=10-(a+1),c(H+)甲=10c(H+)乙,酸溶液中水电离出的c(H+)等于溶液中c(OH-),c(OH-)=![]() ,所以氢氧根离子浓度:10c (OH-)甲=c(OH-)乙,则水电离出的氢离子浓度10c(H+)甲=c(H+)乙,A错误;
,所以氢氧根离子浓度:10c (OH-)甲=c(OH-)乙,则水电离出的氢离子浓度10c(H+)甲=c(H+)乙,A错误;
B.酸的浓度越大,酸的电离程度越小,与等量NaOH反应,酸的浓度越大则消耗酸的体积越小,c(甲)>10c(乙),所以消耗酸的体积,10V(甲)<V(乙),B错误;
C.酸的浓度越大,酸的电离程度越小,c(甲)>10c(乙),C正确;
D.c(OH-)=![]() ,所以氢氧根离子浓度:10c (OH-)甲=c(OH-)乙,D错误;
,所以氢氧根离子浓度:10c (OH-)甲=c(OH-)乙,D错误;
答案选C。

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
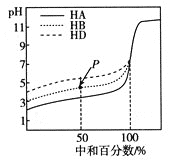
名师指导一卷通系列答案【题目】下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)在这些元素中,金属性最强的元素是_____,最活泼的非金属元素是_______________
(2)化学性质最不活泼的元素是______________,其原子的原子结构示意图为___________;
(3)元素的最高价氧化物对应的水化物中酸性最强的是______________,碱性最强的是____________,
(4)在③~⑦元素中,原子半径最大的是________,原子半径最小的是_______;
【题目】某校化学课外研究小组为验证浓硫酸与金属Zn反应产生的气体中含SO2和H2,进行了下列实验活动:
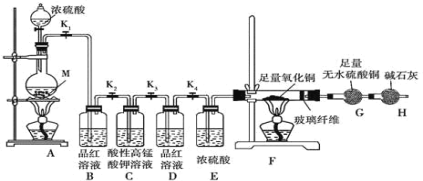
(1)在装入药品前,甲同学需检查装置_____。
(2)填写下表中的实验现象:_____。
装置 | B | F | G |
实验现象 |
(3)装置C的作用是_____,写出装置C中发生反应的离子方程式_____。
(4)装置D的作用是_____。
(5)SO2是大气污染物之一,也是某工业生产中的主要尾气之一。某校兴趣小组欲采用下列方案测定此工业尾气中的SO2的含量。
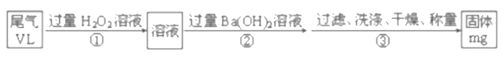
通过的尾气体积为VL(已换算成标准状况)时,该尾气中SO2含量(体积分数)为_____(用含有V、m的代数式表示)。
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(III)的处理工艺流程如下。
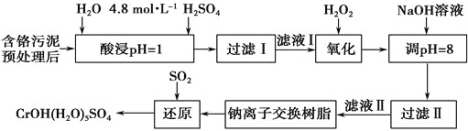
其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)酸浸时,为了提高浸取率可采取的措施有______________![]() 答出两点
答出两点![]() 。
。
(2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:_____________。
(3)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 2.7 |
|
|
|
沉淀完全时的pH | 3.7 | 11.1 | 8 | 9(>9溶解) |
加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-。滤液Ⅱ中阳离子主要有________;但溶液的pH不能超过8,其理由是_______________。
(4)写出上述流程中用SO2进行还原时发生反应的化学方程式: ____________。
(5)滴定法测定纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品Wg,放入锥形瓶中加蒸馏水溶解,加1~2滴酚酞指示剂,用cmol/L的HCl溶液滴定至溶液由红色变为无色![]() 指示
指示![]() 反应的终点
反应的终点![]() ,所用HCl溶液体积为V1mL,再加1~2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄色变为橙色,所用HCI溶液总体积为V2mL,则纯碱样品中NaHCO3质量分数为____________。
,所用HCl溶液体积为V1mL,再加1~2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄色变为橙色,所用HCI溶液总体积为V2mL,则纯碱样品中NaHCO3质量分数为____________。
【题目】己知HNO2在低温下较稳定,既有氧化性又有还原性,其氧化产物、还原产物与溶液pH的关系如下表,且酸性:![]() 。下列有关说法错误的是
。下列有关说法错误的是![]()
![]()
pH范围 |
|
|
产物 |
| NO、 |
A.碱性条件下,NaNO2与NaClO反应的离子方程式为![]()
B.向冷的NaNO2溶液中通入H2S气体,有淡黄色沉淀产生
C.低温时不用其它试剂即可区分HNO2溶液与Na2CO3溶液
D.向冷的NaNO2溶液中通入SO2可得到HNO2