题目内容
(1)请用下列10种物质的序号填空:
①O2 ②H2 ③NH4NO3 ④K2O2 ⑤Ba(OH)2 ⑥CH4 ⑦CO2 ⑧NaF ⑨NH3 ⑩I2
(1)其中既有离子键又有非极性键的是 ;既有离子键又有极性键的是 .
(2)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,其电子式为 ;若XY2为共价化合物时,其结构式为 .
(3)氯化铝的物理性质非常特殊,如:氯化铝的熔点为190℃,但在180℃就开始升华.据此判断,氯化铝是 (填“共价化合物”或“离子化合物”),可以证明你的判断正确的实验依据是 .
(4)现有a~g 7种短周期元素,它们在周期表中的位置如图所示,请据此回答下列问题:
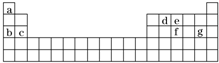
①元素的原子间反应最容易形成离子键的是 (填序号)
A.c和f B.b和g C.d和g D.b和e
②写出a~g 7种元素形成的所有原子都满足最外层为8电子结构的任意一种分子的分子式 .
①O2 ②H2 ③NH4NO3 ④K2O2 ⑤Ba(OH)2 ⑥CH4 ⑦CO2 ⑧NaF ⑨NH3 ⑩I2
(1)其中既有离子键又有非极性键的是
(2)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,其电子式为
(3)氯化铝的物理性质非常特殊,如:氯化铝的熔点为190℃,但在180℃就开始升华.据此判断,氯化铝是
(4)现有a~g 7种短周期元素,它们在周期表中的位置如图所示,请据此回答下列问题:

①元素的原子间反应最容易形成离子键的是
A.c和f B.b和g C.d和g D.b和e
②写出a~g 7种元素形成的所有原子都满足最外层为8电子结构的任意一种分子的分子式
考点:位置结构性质的相互关系应用,元素周期律和元素周期表的综合应用,离子化合物的结构特征与性质,共价键的形成及共价键的主要类型
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:(1)一般金属元素与非金属元素形成离子键,不同非金属元素之间形成极性共价键,同种非金属元素之间形成非极性共价键,以此来解答;
(2)X、Y两种主族元素能形成XY2型化合物,XY2中共有38个电子,若XY2为常见元素形成的离子化合物,X为第IIA族元素、Y为第VIIA族元素,其电子数是38,则为CaF2;若XY2为共价化合物时,则X为第IVA族元素、Y为第VIA族元素,其电子数为38,则为CS2;
(3)氯化铝的熔点为190℃,但在180℃就开始升华,熔点较低,应为共价化合物;共价化合物在熔融状态下不导电;
(4)根据元素在周期表中的位置知,a、b、c、d、e、f、g分别是H、Na、Mg、C、N、P、Cl元素,
①一般来说,活泼金属和活泼非金属元素之间易形成离子键;
②在ABn型化合物中,如果A的族序数+成键电子对数=8,则该分子中所有原子都达到8电子稳定结构.
(2)X、Y两种主族元素能形成XY2型化合物,XY2中共有38个电子,若XY2为常见元素形成的离子化合物,X为第IIA族元素、Y为第VIIA族元素,其电子数是38,则为CaF2;若XY2为共价化合物时,则X为第IVA族元素、Y为第VIA族元素,其电子数为38,则为CS2;
(3)氯化铝的熔点为190℃,但在180℃就开始升华,熔点较低,应为共价化合物;共价化合物在熔融状态下不导电;
(4)根据元素在周期表中的位置知,a、b、c、d、e、f、g分别是H、Na、Mg、C、N、P、Cl元素,
①一般来说,活泼金属和活泼非金属元素之间易形成离子键;
②在ABn型化合物中,如果A的族序数+成键电子对数=8,则该分子中所有原子都达到8电子稳定结构.
解答:
解:①O2、②H2、⑩I2中只含有非极性共价键;
⑥CH4、⑦CO2、⑨NH3中只含有极性共价键;
⑧NaF中只含有离子键;
④K2O2中钾离子与过氧根离子以离子键结合,O、O之间以非极性共价键结合,既有离子键又有非极性键;
③NH4NO3中氯离子和硝酸根离子之间存在离子键,铵根离子中氮原子和氢原子之间、硝酸根离子中氮原子和氧原子之间存在极性共价键,既有离子键又有极性键;
⑤Ba(OH)2中钡离子和氢氧根离子间存在离子键,氢氧根离子中氧原子和氢原子之间存在极性共价键,既有离子键又有极性键;
故答案为:④;③⑤;
(2)X、Y两种主族元素能形成XY2型化合物,XY2中共有38个电子,若XY2为常见元素形成的离子化合物,X为第IIA族元素、Y为第VIIA族元素,其电子数是38,则为CaF2,其电子式 ,若XY2为共价化合物时,则X为第IVA族元素、Y为第VIA族元素,其电子数为38,则为CS2,其结构式为S=C=S;
,若XY2为共价化合物时,则X为第IVA族元素、Y为第VIA族元素,其电子数为38,则为CS2,其结构式为S=C=S;
故答案为: ;S=C=S;
;S=C=S;
(3)氯化铝的熔点为190℃,但在180℃就开始升华,熔点较低,应为共价化合物;氯化铝在熔融状态下不导电,说明为共价化合物;
故答案为:共价化合物;氯化铝在熔融状态下不导电;
(4)根据元素在周期表中的位置知,a、b、c、d、e、f、g分别是H、Na、Mg、C、N、P、Cl元素,
①一般来说,活泼金属和活泼非金属元素之间易形成离子键,所以容易形成离子键的是钠和氯,故答案为:B;
②在ABn型化合物中,如果A的族序数+成键电子对数=8,则该分子中所有原子都达到8电子稳定结构,如CCl4,故答案为:CCl4.
⑥CH4、⑦CO2、⑨NH3中只含有极性共价键;
⑧NaF中只含有离子键;
④K2O2中钾离子与过氧根离子以离子键结合,O、O之间以非极性共价键结合,既有离子键又有非极性键;
③NH4NO3中氯离子和硝酸根离子之间存在离子键,铵根离子中氮原子和氢原子之间、硝酸根离子中氮原子和氧原子之间存在极性共价键,既有离子键又有极性键;
⑤Ba(OH)2中钡离子和氢氧根离子间存在离子键,氢氧根离子中氧原子和氢原子之间存在极性共价键,既有离子键又有极性键;
故答案为:④;③⑤;
(2)X、Y两种主族元素能形成XY2型化合物,XY2中共有38个电子,若XY2为常见元素形成的离子化合物,X为第IIA族元素、Y为第VIIA族元素,其电子数是38,则为CaF2,其电子式
 ,若XY2为共价化合物时,则X为第IVA族元素、Y为第VIA族元素,其电子数为38,则为CS2,其结构式为S=C=S;
,若XY2为共价化合物时,则X为第IVA族元素、Y为第VIA族元素,其电子数为38,则为CS2,其结构式为S=C=S;故答案为:
 ;S=C=S;
;S=C=S;(3)氯化铝的熔点为190℃,但在180℃就开始升华,熔点较低,应为共价化合物;氯化铝在熔融状态下不导电,说明为共价化合物;
故答案为:共价化合物;氯化铝在熔融状态下不导电;
(4)根据元素在周期表中的位置知,a、b、c、d、e、f、g分别是H、Na、Mg、C、N、P、Cl元素,
①一般来说,活泼金属和活泼非金属元素之间易形成离子键,所以容易形成离子键的是钠和氯,故答案为:B;
②在ABn型化合物中,如果A的族序数+成键电子对数=8,则该分子中所有原子都达到8电子稳定结构,如CCl4,故答案为:CCl4.
点评:本题考查了化学键、共价化合物、元素周期表的综合应用等知识点,根据物质的构成微粒确定化学键类型,知道8电子稳定结构的判断方法,题目难度不大.

练习册系列答案
相关题目
下列化学用语书写正确的是( )
| A、氢气分子的电子式:H:H |
B、硫原子的结构示意图: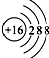 |
C、溴化钠的电子式: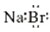 |
D、苯的分子式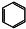 |
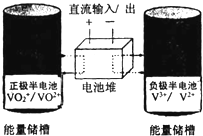 全钒氧化还原液流电池是一种新型电能储存和高效转化装置,该电池是将具有不同价态的钒离子溶液分别作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中.其结构原理如图所示,该电池放电时,右槽中的电极反应为:V2+-e-═V3+,下列说法正确的是( )
全钒氧化还原液流电池是一种新型电能储存和高效转化装置,该电池是将具有不同价态的钒离子溶液分别作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中.其结构原理如图所示,该电池放电时,右槽中的电极反应为:V2+-e-═V3+,下列说法正确的是( )| A、放电时,右槽发生还原反应 |
| B、放电时,左槽电解液pH升高 |
| C、充电时,阴极的电极反应式:VO2++2H++e-═VO++H2O |
| D、充电时,每转移1mol电子,n(H+)的变化量为1mol |
有相同的三块铝片,进行如下实验
实验一:取第一块铝片,直接放入硫酸铜溶液中观察现象
实验二:取第二块铝片,用砂纸擦试表面后,放入硫酸铜溶液中观察现象
实验三:将实验一中铝片从硫酸铜溶液中取出,洗净后放入氢氧化钠溶液中,片刻后取出铝片,洗净后再放入硫酸铜溶液中观察现象
实验四:取第三块铝片,用砂纸擦试表面后,置于浓硝酸中,片刻后取出,洗净,再放入硫酸铜溶液中观察现象
综合以上四个实验的主要目的是试图说明( )
实验一:取第一块铝片,直接放入硫酸铜溶液中观察现象
实验二:取第二块铝片,用砂纸擦试表面后,放入硫酸铜溶液中观察现象
实验三:将实验一中铝片从硫酸铜溶液中取出,洗净后放入氢氧化钠溶液中,片刻后取出铝片,洗净后再放入硫酸铜溶液中观察现象
实验四:取第三块铝片,用砂纸擦试表面后,置于浓硝酸中,片刻后取出,洗净,再放入硫酸铜溶液中观察现象
综合以上四个实验的主要目的是试图说明( )
| A、铝片表面能形成具有保护作用的氧化膜 |
| B、铝片能和氢氧化钠溶液反应 |
| C、铝片不能和硝酸反应 |
| D、铝片能和硫酸铜溶液反应 |
 和
和 :
: ,
, 和C6H12(已烯):
和C6H12(已烯):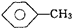 ,CCl4和乙醇
,CCl4和乙醇 的系统命名:
的系统命名: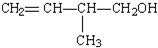 的键线式:
的键线式: