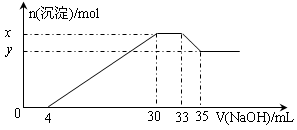
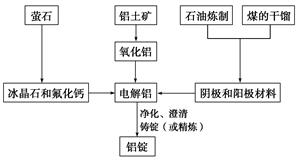
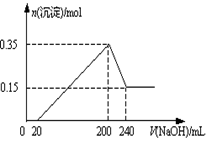
题目内容
铝分别与足量的稀硫酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的硫酸和NaOH物质的量之比为
| A.1:1 | B.3:1 | C.3:2 | D.1:3 |
C
试题分析:反应的有关方程式为:铝与盐酸:2Al+6HCl=2AlCl3+3H2↑,铝与NaOH溶液:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;假设生成的氢气的物质的量为3mol,根据方程式计算NaOH、HCl的物质的量,从而计算出氢氧化钠和氯化氢物质的量的之比。设生成的氢气的物质的量为3mol,则:
2Al+6HCl=2AlCl3+3H2↑
6mol 3mol
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2mol 3mol
所以所取氢氧化钠和盐酸溶液中NaOH、HCl的物质的量的之比为2mol:6mol=1:3,因此答案选C。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目