题目内容
【题目】A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E三种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)写出元素的名称:C__________,D___________。
(2)写出元素的原子结构示意图:A______________,B______________,二者离子半径:_______>_________ (填化学式,下同)。
(3)A、B的最高价氧化物的水化物的碱性:______________>______________。
(4)D、E的气态氢化物的稳定性:______________>______________。
【答案】 硅 磷 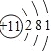
![]() Na+ Al3+ NaOH Al(OH)3 HCl PH3
Na+ Al3+ NaOH Al(OH)3 HCl PH3
【解析】本题考查元素周期表中“位构性”性质的应用,A、B、E三种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,三种元素的原子序数依次增大,即A为Na,B为Al,最外层共有11个电子,即E为Cl,C元素最外层电子数比次外层电子数少4,即C为Si,D元素原子的次外层电子数比最外层电子数多3,即D为P,(1)C为硅,D为磷;(2)Na的原子结构示意图为: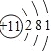 ,铝原子的结构示意图为
,铝原子的结构示意图为![]() ,电子层相同,半径随着原子序数的递增而减小,即r(Na+)>r(Al3+);(3)Na的金属性强于Al的金属性,即NaOH的碱性强于Al(OH)3;(4)非金属性:Cl>P,其氢化物的稳定性为HCl>PH3.
,电子层相同,半径随着原子序数的递增而减小,即r(Na+)>r(Al3+);(3)Na的金属性强于Al的金属性,即NaOH的碱性强于Al(OH)3;(4)非金属性:Cl>P,其氢化物的稳定性为HCl>PH3.

练习册系列答案
相关题目