题目内容
某一反应体系中,MnO2+4HCl=MnCl2+2H2O+Cl2↑.
(1)该反应中的氧化剂是______.
(2)标出电子转移的方向和数目:______.
(3)该反应中,氧化剂与还原剂的物质的量之比为______.
(4)若产生的气体在标准状况下体积为2.24L,则反应过程中转移电子的数目为______.
解:(1)因反应中二氧化锰中的Mn元素的化合价降低,则二氧化锰为氧化剂,故答案为:MnO2;
(2)该反应中Cl元素失去电子,Mn元素得到电子,转移的电子总数为2e-,则电子转移的方向和数目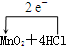 (浓)═MnCl2+Cl2↑+2H2O,故答案为:
(浓)═MnCl2+Cl2↑+2H2O,故答案为: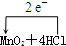 (浓)═MnCl2+Cl2↑+2H2O;
(浓)═MnCl2+Cl2↑+2H2O;
(3)由MnO2+4HCl=MnCl2+2H2O+Cl2↑可知,1molMnO2反应时氧化剂为1mol,但参加反应的4molHCl中只有
2molHCl作还原剂,即氧化剂与还原剂的物质的量之比为1:2,故答案为:1:2;
(4)标准状况下体积为2.24L氯气其物质的量为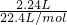 =0.1mol,
=0.1mol,
由MnO2+4HCl=MnCl2+2H2O+Cl2↑~2e-可知,生成0.1molCl2时,转移的电子数为0.1×2×NA=0.2NA(或写为1.204×1023),故答案为:0.2NA(或写为1.204×1023).
分析:(1)反应物中含元素化合价降低得物质为氧化剂;
(2)根据失去电子的元素和得到电子的元素及转移的电子总数来标出电子转移的方向和数目;
(3)根据氧化还原反应方程式来分析;
(4)根据氧化还原反应方程式及氯气的体积进行计算.
点评:本题考查氧化还原反应,明确元素的化合价变化是解答本题得关键,并熟悉基本概念及利用化合价的变化来计算转移的电子数来解答即可.
(2)该反应中Cl元素失去电子,Mn元素得到电子,转移的电子总数为2e-,则电子转移的方向和数目
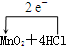 (浓)═MnCl2+Cl2↑+2H2O,故答案为:
(浓)═MnCl2+Cl2↑+2H2O,故答案为: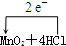 (浓)═MnCl2+Cl2↑+2H2O;
(浓)═MnCl2+Cl2↑+2H2O;(3)由MnO2+4HCl=MnCl2+2H2O+Cl2↑可知,1molMnO2反应时氧化剂为1mol,但参加反应的4molHCl中只有
2molHCl作还原剂,即氧化剂与还原剂的物质的量之比为1:2,故答案为:1:2;
(4)标准状况下体积为2.24L氯气其物质的量为
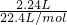 =0.1mol,
=0.1mol,由MnO2+4HCl=MnCl2+2H2O+Cl2↑~2e-可知,生成0.1molCl2时,转移的电子数为0.1×2×NA=0.2NA(或写为1.204×1023),故答案为:0.2NA(或写为1.204×1023).
分析:(1)反应物中含元素化合价降低得物质为氧化剂;
(2)根据失去电子的元素和得到电子的元素及转移的电子总数来标出电子转移的方向和数目;
(3)根据氧化还原反应方程式来分析;
(4)根据氧化还原反应方程式及氯气的体积进行计算.
点评:本题考查氧化还原反应,明确元素的化合价变化是解答本题得关键,并熟悉基本概念及利用化合价的变化来计算转移的电子数来解答即可.

练习册系列答案
相关题目