题目内容
科研、生产中常涉及钠、硫及其化合物。
(1)实验室可用无水乙醇处理少量残留的金属钠,化学反应方程式为 。要清洗附着在试管壁上的硫,可用的试剂是 。
(2)如图为钠高能电池的结构示意图,该电池的工作温度为320 ℃左右,电池反应为2Na+xS=Na2Sx,正极的电极反应式为 。M(由Na2O和Al2O3制得)的两个作用是 。
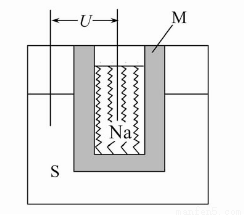
与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的 __ 倍。
(3)Na2S溶液中离子浓度由大到小的顺序为 ,向该溶液中加入少量固体CuSO4,溶液pH (填“增大”、“减小”或“不变”),Na2S溶液长期放置有硫析出,原因为 (用离子方程式表示)。
(1)2CH3CH2OH+2Na 2CH3CH2ONa+H2↑ CS2(或热的NaOH溶液)
2CH3CH2ONa+H2↑ CS2(或热的NaOH溶液)
(2)xS+2e-=Sx2- (或2Na++xS+2e-=Na2Sx) 导电和隔离钠与硫 4.5
(3)c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+) 减小 2S2-+O2+2H2O=4OH-+2S↓
【解析】(2)正极的电极反应式为:xS+2e-= Sx2-,M的作用:一是导电,二是因钠与硫易反应,故它起到隔离作用;钠高能电池中负极为钠,有23 g钠消耗释放1 mol e-,则207 g钠消耗时转移207/23 mol e-,铅蓄电池的电极反应为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,铅蓄电池中铅是负极,207 g铅消耗时转移2 mol e-,故钠硫电池的理论放电量是铅蓄电池的(207/23)∶2=4.5倍。
(3)根据电离与水解的知识可判断:c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+),加入少量固体CuSO4后,溶液中发生离子反应:Cu2++S2-=CuS↓,由于c(S2-)降低,故由S2-水解产生的OH-量减小,c(OH-)变小,c(H+)变大,溶液的pH减小;Na2S溶液长期放置所发生的化学反应方程式为2Na2S+O2+2H2O=4NaOH+2S↓,故离子方程式为2S2-+O2+2H2O=4OH-+2S↓。

以黄铜矿(主要成分为CuFeS2,含少量杂质SiO2等)为原料进行炼铜,同时得到副产品绿矾(FeSO4·7H2O)。其主要流程如下:

已知:① 4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O
②部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如表
沉淀物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
开始沉淀pH | 4.7 | 2.7 | 7.6 |
完全沉淀pH | 6.7 | 3.7 | 9.6 |
(1)试剂a是__________,试剂b是__________。
(2)操作X应为蒸发浓缩、__________、__________。
(3)反应Ⅱ中加CuO调pH为__________,目的是使Fe3+形成Fe(OH)3沉淀,防止生成Cu(OH)2沉淀。
(4)反应Ⅴ的离子方程式为:__________________________________________。







