题目内容
【题目】电化学应用广泛。请回答下列问题:
(1)自发进行的氧化还原反应可以设计成原电池。若电池放电时的反应式为:2Cu+2H2SO4+O2= 2CuSO4+2H2O,该电池的负极材料为_______;正极的电极反应式为____________。
(2)燃料电池和二次电池的应用非常广泛。
①如图为甲烷燃料电池的示意图,则负极的电极反应式为_____________________;
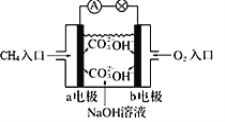
②铅蓄电池为生活中常用的二次电池。放电时的反应为:PbO2 +Pb+2H2SO4=2PbSO4 + 2H2O,铅蓄电池负极的电极反应式为_____;充电时,铅蓄电池的PbO2极应与外加直流电源的____极相连。
(3)以铅蓄电池为电源精炼粗铜(含Fe、Pb、Ag、Au及其他不反应物质)时,以硫酸铜溶液为电解质溶液,粗铜做____极;精炼一段时间后,当阴极增重128 g时,铅蓄电池参加反应的硫酸的物质的量为____mol。
【答案】铜或Cu O2+4e-+4H+=2H2O CH4+10OH--8e-=CO32-+7H2O Pb +SO42--2e-=PbSO4 正 阳 4
【解析】
根据原电池、燃料电池、铅蓄电池原理判断正负极及书写相关电极反应式;根据电解精炼铜原理分析阴阳极、结合电子守恒进行相关计算。
(1)原电池中负极失去电子,发生氧化反应,化合价升高,根据总反应知,Cu化合价升高,则该电池的负极材料为Cu;正极得电子,发生还原反应,正极的电极反应式为:O2+4e-+4H+=2H2O;
(2)①如图所示该电池为碱性燃料电池,甲烷作负极,失电子后结合氢氧根生成碳酸根,则负极的电极反应式为:CH4+10OH--8e-=CO32-+7H2O;
②根据总反应分析知,放电时,铅蓄电池负极失去电子,化合价升高,电极反应式为:Pb +SO42--2e-=PbSO4;充电时,铅蓄电池的PbO2极要转化为Pb,发生还原反应,所以应与外加直流电源的正极相连;
(3)精炼时,粗铜要被溶解发生氧化反应,所以做阳极;当阴极增重128 g时,n(Cu)=![]() =2mol,阴极电极反应为Cu2++2e-=Cu,由总反应PbO2 +Pb+2H2SO4=2PbSO4 + 2H2O~2e-得:n(硫酸)=n(e-)=2mol×2=4mol。
=2mol,阴极电极反应为Cu2++2e-=Cu,由总反应PbO2 +Pb+2H2SO4=2PbSO4 + 2H2O~2e-得:n(硫酸)=n(e-)=2mol×2=4mol。

 名校课堂系列答案
名校课堂系列答案