题目内容
反应4A(g) + 5B(g) 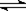 4C(g) + 6D(g) △H =-Q kJ/mol,在一定温度下达到化学平衡状态时,下列说法正确的是:
4C(g) + 6D(g) △H =-Q kJ/mol,在一定温度下达到化学平衡状态时,下列说法正确的是:
A. 若增大压强,A和B的转化率都增大
B. 若升高温度最终能生成更多的C和D
C. 单位时间里有4n mol A消耗,同时有5n mol B生成
D. 容器里A、B、C、D的浓度比是4:5:4:6
【答案】
C
【解析】该反应是体积增大的放热的可逆反应。增大压强,平衡向逆反应方向移动,A和B的转化率都减小,A不正确。升高温度平衡也向逆反应方向移动,不利于CD的生成,B不正确。平衡后单位时间里有4n mol A消耗,必然同时生成4n mol A,根据速率之比是化学计量数之比,同时也应该生成5n mol B,C正确。达到平衡后 容器里A、B、C、D的浓度比不一定是4:5:4:6 ,D不正确。

练习册系列答案
相关题目

 2C(g)+6D在不同压强下B%(B的体积百分含量)随时间的变化,则D一定是气体
2C(g)+6D在不同压强下B%(B的体积百分含量)随时间的变化,则D一定是气体