题目内容
将19.2g 的Cu投入3mol/L 400mL过量的稀硝酸中,微热,充分反应至Cu完全溶解,用排水集气法收集生成的气体.
(1)写出Cu与稀硝酸反应的化学方程式,并用单线桥法标出电子转移的方向和数目.
(2)用排水集气法收集生成的气体的体积(标准状况)最多为
(3)反应结束后,所得溶液(反应前后溶液的体积变化忽略不计)中H+的物质的量浓度是多少?(要求写出计算过程)
(1)写出Cu与稀硝酸反应的化学方程式,并用单线桥法标出电子转移的方向和数目.
(2)用排水集气法收集生成的气体的体积(标准状况)最多为
4.48
4.48
L.(3)反应结束后,所得溶液(反应前后溶液的体积变化忽略不计)中H+的物质的量浓度是多少?(要求写出计算过程)
分析:(1)根据反应物生成物写出反应方程式,单线桥标电子转移的方向是:由还原剂指向氧化剂.
(2)根据铜的物质的量算出生成的气体体积.
(3)先根据铜的物质的量算出反应的硝酸的物质的量,继而算出剩余的硝酸的物质的量,根据物质的量浓度公式算出氢离子的浓度.
(2)根据铜的物质的量算出生成的气体体积.
(3)先根据铜的物质的量算出反应的硝酸的物质的量,继而算出剩余的硝酸的物质的量,根据物质的量浓度公式算出氢离子的浓度.
解答:解:(1)铜和稀硝酸反应生成硝酸铜和一氧化氮、水;根据化合价变化判断:氧化剂是硝酸,还原剂是铜,故答案为:
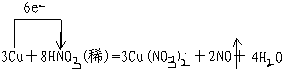
(2)由题意知,硝酸是过量的,以铜为标准进行计算,设生成的气体的体积为xL,
n(Cu)=
=0.3mol
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
3 2×22.4L
0.3mol xL
x=4.48
故答案为:4.48;
(3)n(Cu)=
=0.3mol
n(HNO3)=3mol/L×0.4L=1.2mol
3Cu+8HNO3 (稀)=3Cu(NO3)2+2NO↑+4H2O
3mol 8mol
0.3mol 0.8mol
n(H+)=1.2mol-0.8mol=0.4mol
c(H+)=
=1mol/L
故答案为:1mol/L
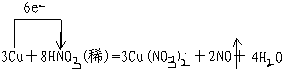
(2)由题意知,硝酸是过量的,以铜为标准进行计算,设生成的气体的体积为xL,
n(Cu)=
| 19.2g |
| 64g/mol |
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
3 2×22.4L
0.3mol xL
x=4.48
故答案为:4.48;
(3)n(Cu)=
| 19.2g |
| 64g/mol |
n(HNO3)=3mol/L×0.4L=1.2mol
3Cu+8HNO3 (稀)=3Cu(NO3)2+2NO↑+4H2O
3mol 8mol
0.3mol 0.8mol
n(H+)=1.2mol-0.8mol=0.4mol
c(H+)=
| 0.4mol |
| 0.4L |
故答案为:1mol/L
点评:因为已知两种反应物的物理量,所以要注意过量计算,应以不足量的物质为标准进行分析该题,本题也考查了学生认真审题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目