题目内容
(1)金属钛(22Ti)将是继铜、铁、铝之后人类广泛使用的第四种金属,请你写出钛的基态原子的电子排布式
(2)二氧化钛作光催化剂能将居室污染物甲醛、苯、二甲苯等有害物质可转化为二氧化碳和水,达到无害化.有关甲醛、苯、二甲苯、二氧化碳及水说法正确的是
A.苯与B3N3H6互为等电子体,分子中原子共平面,且都有三种二氯代物;
B.二氧化碳、甲醛、氯仿(CHCl3)中碳原子分别采用sp、sp2、sp3杂化;
C.对二甲苯是非极性分子,邻二甲苯和间二甲苯都是极性分子;
D.氨比甲醛易溶于水,是因为甲醛与水分子间不能形成氢键.
(3)日常生活中广泛使用的不锈钢就是含铬合金,铬元素原子中末成对电子数为
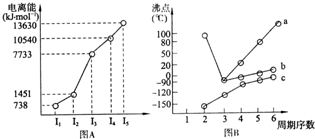
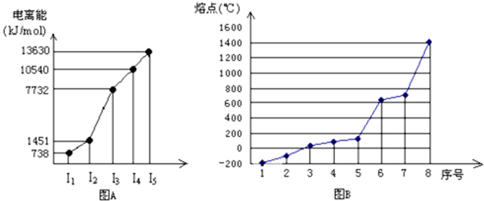
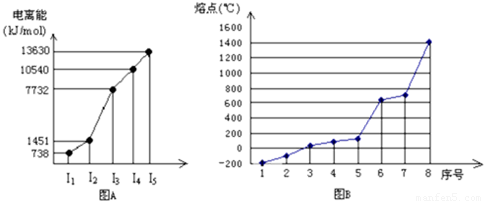
(4)①短周期某主族元素M的逐级电离能情况如下图A所示,则M元素形成化合物时,表现的主要化合价为
②第三周期八种元素按单质熔点高低的顺序如下图B所示,其中序号“8”代表

(5)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料.科学家把C60和K掺杂在一起制造了一种富勒烯 化合
化合
物,其晶胞如图所示,该物质在低温时是一种超导体.该物质的K原子和C60分子的个数比为
(6)在配合物Fe(SCN)2+离子中,提供空轨道接受孤对电子的微粒是
1S22S22P63S23P63d24S2
1S22S22P63S23P63d24S2
.(2)二氧化钛作光催化剂能将居室污染物甲醛、苯、二甲苯等有害物质可转化为二氧化碳和水,达到无害化.有关甲醛、苯、二甲苯、二氧化碳及水说法正确的是
BC
BC
.A.苯与B3N3H6互为等电子体,分子中原子共平面,且都有三种二氯代物;
B.二氧化碳、甲醛、氯仿(CHCl3)中碳原子分别采用sp、sp2、sp3杂化;
C.对二甲苯是非极性分子,邻二甲苯和间二甲苯都是极性分子;
D.氨比甲醛易溶于水,是因为甲醛与水分子间不能形成氢键.
(3)日常生活中广泛使用的不锈钢就是含铬合金,铬元素原子中末成对电子数为
6
6
.(4)①短周期某主族元素M的逐级电离能情况如下图A所示,则M元素形成化合物时,表现的主要化合价为
+2
+2
价.②第三周期八种元素按单质熔点高低的顺序如下图B所示,其中序号“8”代表
Si
Si
(填元素符号),其中电负性最大的是2
2
(填图B中的序号)
(5)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料.科学家把C60和K掺杂在一起制造了一种富勒烯
 化合
化合物,其晶胞如图所示,该物质在低温时是一种超导体.该物质的K原子和C60分子的个数比为
3:1
3:1
.(6)在配合物Fe(SCN)2+离子中,提供空轨道接受孤对电子的微粒是
Fe3+
Fe3+
.分析:(1)根据能量最低原理书写基态原子电子排布式;
(2)A.B3N3H6的二氯代物有邻、间、对三种情况,其中相间位置有二种;
B.根据中心原子形成的δ键和孤电子对数判断二氧化碳、甲醛、氯仿(CHCl3)中碳原子的杂化类型;
C.从结构对称的角度判断正负电荷重心是否重叠;
D.甲醛与水分子间能形成氢键.
(3)根据铬元素的基态原子电子排布式来分析;
(4)①元素形成化合物时失电子数显示的正价数和第几级电离能数值有关系;
②原子晶体的熔点最高,金属晶体的次之,分子晶体的最小;
(5)利用均摊法计算;
(6)根据配合物中微粒含有的空轨道知识来回答.
(2)A.B3N3H6的二氯代物有邻、间、对三种情况,其中相间位置有二种;
B.根据中心原子形成的δ键和孤电子对数判断二氧化碳、甲醛、氯仿(CHCl3)中碳原子的杂化类型;
C.从结构对称的角度判断正负电荷重心是否重叠;
D.甲醛与水分子间能形成氢键.
(3)根据铬元素的基态原子电子排布式来分析;
(4)①元素形成化合物时失电子数显示的正价数和第几级电离能数值有关系;
②原子晶体的熔点最高,金属晶体的次之,分子晶体的最小;
(5)利用均摊法计算;
(6)根据配合物中微粒含有的空轨道知识来回答.
解答:解:(1)铬元素在周期表中是22号元素,基态原子的电子排布式为:1s22s22p63s23p63d24s2,
故答案为:1S22S22P63S23P63d24S2;
(2)A.B3N3H6的二氯代物有邻、间、对三种情况,其中相间位置有二种,共由四种,故A错误;
B.二氧化碳、甲醛、氯仿(CHCl3)中碳原子分别形成2、3、4个δ键,都没有孤电子对,则分别采用sp、sp2、sp3杂化,故B正确;
C.对二甲苯结构对称,是非极性分子,邻二甲苯和间二甲苯结构都不对称,都是极性分子,故C正确;
D.甲醛与水分子间能形成氢键,但氨气形成氢键较低,分子极性较大,更易溶于水,故D错误.
故答案为:BC;
(3)铬元素的基态原子电子排布式为:1s22s22p63s23p63d54s1,该元素基态原子未成对电子数为6,故答案为:6;
(4)①根据图A所示,主族元素M的逐级电离能中,第三级电离能骤然增大,说明M很难失去第三个电子,而更易失去两个电子,故化合价为+2价,故答案为:+2;
②第三周期8种元素的单质中只有单质硅是原子晶体,熔点最高,同周期元素的原子,从左到右得电子能力逐渐增强,电负性逐渐增大,电负性逐渐最大的是Cl,其中2为Cl元素,
故答案为:Si;2;
(5)C60位于顶点和体,共有1+8×
=2,K位于面心,共有12×
=6,则K原子和C60分子的个数比为3:1,故答案为:3:1;
(6)在配合物Fe(SCN)2+中,三价铁离子含有空轨道,可以接受孤对电子,故答案为:Fe3+.
故答案为:1S22S22P63S23P63d24S2;
(2)A.B3N3H6的二氯代物有邻、间、对三种情况,其中相间位置有二种,共由四种,故A错误;
B.二氧化碳、甲醛、氯仿(CHCl3)中碳原子分别形成2、3、4个δ键,都没有孤电子对,则分别采用sp、sp2、sp3杂化,故B正确;
C.对二甲苯结构对称,是非极性分子,邻二甲苯和间二甲苯结构都不对称,都是极性分子,故C正确;
D.甲醛与水分子间能形成氢键,但氨气形成氢键较低,分子极性较大,更易溶于水,故D错误.
故答案为:BC;
(3)铬元素的基态原子电子排布式为:1s22s22p63s23p63d54s1,该元素基态原子未成对电子数为6,故答案为:6;
(4)①根据图A所示,主族元素M的逐级电离能中,第三级电离能骤然增大,说明M很难失去第三个电子,而更易失去两个电子,故化合价为+2价,故答案为:+2;
②第三周期8种元素的单质中只有单质硅是原子晶体,熔点最高,同周期元素的原子,从左到右得电子能力逐渐增强,电负性逐渐增大,电负性逐渐最大的是Cl,其中2为Cl元素,
故答案为:Si;2;
(5)C60位于顶点和体,共有1+8×
| 1 |
| 8 |
| 1 |
| 2 |
(6)在配合物Fe(SCN)2+中,三价铁离子含有空轨道,可以接受孤对电子,故答案为:Fe3+.
点评:本题是一道结构化学知识的综合题目,侧重于电子排布式、电离能和电负性以及晶胞计算,配合物的分析等,考查学生分析和解决问题的能力,综合性较强,难度较大.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目