题目内容
【题目】
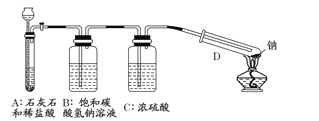
(1)该装置中饱和碳酸氢钠溶液的作用是 ,浓硫酸的作用是 。
(2)从试剂瓶中取出的金属钠,必须经过必要的操作,方可进行后续的实验,该必要的操作是 。
(3)放进试管中的金属钠在加热之前,必须进行的操作是 。
(4)用酒精灯在试管底部加热,钠在充满二氧化碳气体的试管里剧烈地燃烧,产生大量的白烟。试管底部有黑色物质生成。试管冷却后,试管壁上附着一层白色物质。往试管中加水,白色物质溶解于水,黑色物质不溶。过滤,得到澄清的滤液。往滤液中加澄清石灰水,溶液变浑浊。再滴入稀盐酸,溶液中有气泡出现,则试管壁上附着的白色物质是 。然后将滤纸上的黑色物质移入小试管中,加少量浓硫酸,加热,产生有刺激性气味的二氧化硫气体和另一种无色常见气体。则该黑色物质与浓硫酸共热的化学反应方程式为 。
(5)据(4)中现象,试写出钠与二氧化碳反应的化学方程式: 。
【答案】(1)除去CO2中混有的HCl;干燥CO2气体(各2分,共4分)
(2)用滤纸吸干表面的煤油,并用小刀切去表层(2分)
(3)打开活塞,让产生的二氧化碳排尽试管内空气,并继续通入二氧化碳(2分)
(4)Na2CO3C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O(各2分)
CO2↑+2SO2↑+2H2O(各2分)
(5)4Na+3CO2![]() 2Na2CO3+C(2分)
2Na2CO3+C(2分)
【解析】试题分析:(1)要探究钠能否在二氧化碳中燃烧,首先要制取纯净的二氧化碳,装置A的作用是就是制取二氧化碳,盐酸具有挥发性,要想得到干燥、纯净的CO2,必须除去HCl和水蒸气,所以装置B中饱和碳酸氢钠溶液的作用是除去CO2中混有的HCl;浓硫酸的作用是干燥CO2气体。
(2)金属Na保存在煤油中,且表面有氧化膜,则从试剂瓶中取出金属钠后的操作是用滤纸吸干表面的煤油,并用小刀切去表层。
(3)在点燃酒精灯之前,必须除去系统内内的空气,防止钠与空气中的氧气反应,所以进行的操作是打开活塞,让产生的二氧化碳排尽试管内空气,并继续通入二氧化碳。
(4)钠在充满二氧化碳气体的试管里剧烈地燃烧,产生大量的白烟,该白色物质溶于水,再滴入稀盐酸,溶液中有气泡出现,说明有CO2生成,则试管壁上附着的白色物质是碳酸钠;碳可以和浓硫酸反应生成二氧化碳、二氧化硫和水,反应的化学方程式为C+2H2SO4(浓)![]() CO2↑+2SO2↑+ 2H2O;
CO2↑+2SO2↑+ 2H2O;
(5)通过对生成物进行的探究实验可得出钠与二氧化碳反应生成了碳酸钠和碳,该反应的方程式为4Na + 3CO2 ![]() 2Na2CO3 + C。
2Na2CO3 + C。

 阅读快车系列答案
阅读快车系列答案【题目】在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应:X(g)+Y(g)![]() 2Z(g) ΔH<0。一段时间后达到平衡,反应过程中测定的数据如下表:下列说法正确的是
2Z(g) ΔH<0。一段时间后达到平衡,反应过程中测定的数据如下表:下列说法正确的是
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A. 反应前2 min的平均速率v(Z)=2.0×10-3mol·L-1·min-1
B. 其他条件不变,降低温度,反应达到新平衡前:v(逆)>v(正)
C. 保持其他条件不变,起始时向容器中充入0.32 mol气体X和0.32 mol 气体Y,到达平衡时,n(Z)="0.24" mol
D. 该温度下此反应的平衡常数:K=1.44