题目内容
用KMnO4氧化密度为1.19g?cm-3.溶质质量分数为36.5%的HCl溶液.反应方程式如下:
2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
(1)用双线桥法标出上述反应电子转移的方向和数目
(2)15.8gKMnO4能使多少克HCl发生上述反应?有多少克HCl被氧化?
(3)求生成的Cl2 在标准状况下的体积为多少?
2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
(1)用双线桥法标出上述反应电子转移的方向和数目
(2)15.8gKMnO4能使多少克HCl发生上述反应?有多少克HCl被氧化?
(3)求生成的Cl2 在标准状况下的体积为多少?
分析:(1)氧化还原反应中失电子的元素化合价升高,得电子的元素化合价降低,化合价降低数目=化合价升高数目=转移的电子数目;
(2)根据化学方程式进行计算;
(3)根据公式V=nVm进行计算.
(2)根据化学方程式进行计算;
(3)根据公式V=nVm进行计算.
解答:解:(1)根据反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中元素化合价的变化,可得该反应电子转移的方向和数目如下所示:
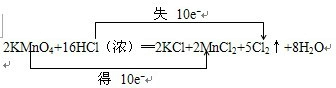 ,故答案为:
,故答案为:
(2)解:15.8gKMnO4的物质的量为:
=0.1mol,发生上述反应的氯化氢的物质的量为x,产生的氯气的物质的量为y,则
2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
2 16 5
0.1mol x y
所以
=
=
解得:x=0.8mol,y=0.25mol
所以发生反应的HCl的质量M=nM=0.8mol×36.5g/mol=29.2g,被氧化的盐酸和参加反应盐酸的物质的量之比为:10:16=5:8,所以被氧化的HCl质量为:29.2g×
=18.25g,
答:参加反应的HCl为29.2g,其中有18.25g被氧化;
(3)标准状况下可产生氯气的体积V=nVm=0.25mol×22.4L/mol=5.6L,
答:生成的Cl2 在标准状况下的体积为5.6L.
 ,故答案为:
,故答案为:
(2)解:15.8gKMnO4的物质的量为:
| 15.8g |
| 158g/mol |
2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
2 16 5
0.1mol x y
所以
| 2 |
| 0.1mol |
| 16 |
| x |
| 5 |
| y |
解得:x=0.8mol,y=0.25mol
所以发生反应的HCl的质量M=nM=0.8mol×36.5g/mol=29.2g,被氧化的盐酸和参加反应盐酸的物质的量之比为:10:16=5:8,所以被氧化的HCl质量为:29.2g×
| 5 |
| 8 |
答:参加反应的HCl为29.2g,其中有18.25g被氧化;
(3)标准状况下可产生氯气的体积V=nVm=0.25mol×22.4L/mol=5.6L,
答:生成的Cl2 在标准状况下的体积为5.6L.
点评:本题考查氧化还原反应的特征和实质以及根据化学方程式的计算知识,是对教材知识的考查,难度不大.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目