题目内容
实验:① 向盛有1 mL 0.1 mol/L MgCl2溶液试管中加1 mL 0.2 mol/L NaOH溶液,得到浊液a,过滤得到滤液b和白色沉淀c。② 向沉淀c中滴加0.1mol/L FeCl3溶液,沉淀变为红褐色。下列分析不正确的是
A.浊液a中存在沉淀溶解平衡:Mg (OH) 2(s) Mg2+(aq)+2OH-(aq) Mg2+(aq)+2OH-(aq) |
| B.滤液b中不含有Mg2+ |
| C.②中颜色变化说明Mg (OH)2转化为Fe(OH)3 |
| D.实验可以证明Fe(OH)3比Mg (OH)2更难溶 |
B
解析试题分析:① 向盛有1 mL 0.1 mol/L MgCl2溶液试管中加1 mL 0.2 mol/L NaOH溶液,恰好发生反应:MgCl2+2NaOH="Mg(OH)" 2↓+2NaCl。Mg(OH) 2在溶液中存在沉淀溶解平衡Mg (OH) 2(s) Mg2+(aq)+2OH-(aq)。所以得到浊液a中含有Mg(OH) 2、NaCl、、及Mg(OH) 2溶液,过滤得到滤液b中含有Mg2+、OH-、Na+、Cl-。和白色沉淀c Mg (OH) 2。② 向沉淀c中滴加0.1mol/L FeCl3溶液,由于在溶液中存在沉淀溶解平衡Mg (OH) 2(s)
Mg2+(aq)+2OH-(aq)。所以得到浊液a中含有Mg(OH) 2、NaCl、、及Mg(OH) 2溶液,过滤得到滤液b中含有Mg2+、OH-、Na+、Cl-。和白色沉淀c Mg (OH) 2。② 向沉淀c中滴加0.1mol/L FeCl3溶液,由于在溶液中存在沉淀溶解平衡Mg (OH) 2(s) Mg2+(aq)+2OH-(aq),Fe3++3OH-=Fe(OH)3↓。破坏了Mg(OH) 2的沉淀溶解平衡,使沉淀溶解平衡正向移动,结果白色沉淀逐渐溶解变为红褐色沉淀,发生沉淀的转化。因此错误的说法是B。
Mg2+(aq)+2OH-(aq),Fe3++3OH-=Fe(OH)3↓。破坏了Mg(OH) 2的沉淀溶解平衡,使沉淀溶解平衡正向移动,结果白色沉淀逐渐溶解变为红褐色沉淀,发生沉淀的转化。因此错误的说法是B。
考点:考查沉淀溶解平衡及沉淀转化的知识。

相同体积的pH=3的强酸溶液和弱酸溶液分别跟足量的镁完全反应
| A.强酸溶液产生较多的氢气 | B.两者产生等量的氢气 |
| C.无法比较两者产生氢气的量 | D.弱酸溶液产生较多的氢气 |
氯化钴溶液中存在下列平衡:CoCl42-(蓝色) Co2+(粉红色)+4Cl-,向氯化钴稀溶液中加入一定量的浓盐酸,溶液的颜色变化是
Co2+(粉红色)+4Cl-,向氯化钴稀溶液中加入一定量的浓盐酸,溶液的颜色变化是
| A.由蓝色变为粉红色 | B.红色加深 |
| C.由粉红色变为蓝色 | D.蓝色加深 |
相同条件下,现有四种溶液:①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液。下列有关说法正确的是( )
| A.由水电离出的c(H+):①=②=③=④ |
| B.将②、③溶液混合后,pH=7,消耗溶液的体积:③>② |
| C.等体积的①、②、④溶液分别与足量铝粉反应,②生成的H2的物质的量最大 |
| D.向溶液中加入100mL水后,溶液的pH:③>④>①>② |
牙齿表面覆盖的牙釉质是人体中最坚硬的部分,起着保护牙齿的作用,其主要成分为羟基磷酸钙[Ca5(PO4)3OH]。在牙齿表面存在着如下平衡:Ca5(PO4)3OH(s) 5Ca2+(aq)+3PO43-(aq)+OH-(aq) Ksp = 6.8×10-37
5Ca2+(aq)+3PO43-(aq)+OH-(aq) Ksp = 6.8×10-37
下列说法错误的是( )
| A.残留在牙齿上的糖发酵会产生H+,经常吃糖易造成龋齿 |
| B.由上述平衡可知,小孩长牙时要少吃糖多补钙 |
| C.若减小OH-的浓度,上述平衡将向右移动,Ksp的值相应增大 |
| D.使用含氟牙膏能防止龋齿,是因为Ca5(PO4)3OH(s)转化为更难溶的Ca5(PO4)3F(s) |
实验:①0.1 mol·L-1 MgCl2溶液和0.2 mol·L-1NaOH溶液等体积混合得到浊液a,取少量浊液a过滤得到滤液b和白色沉淀c;②向浊液a中滴加0.1 mol·L-1FeCl3溶液,出现红褐色沉淀。
下列分析不正确的是
| A.滤液b的pH=7 |
| B.②中颜色变化说明Mg(OH)2转化为Fe(OH)3 |
| C.实验可以证明Fe(OH)3的溶解度比Mg(OH)2的小 |
D.浊液a中存在沉淀溶解平衡:Mg(OH)2(s) Mg2+(aq)+ 2OH-(aq) Mg2+(aq)+ 2OH-(aq) |
有关电解质溶液的叙述,下列说法中正确的是
A.0.2 mol·L-1氨水中,c(OH-)与c(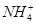 )相等 )相等 |
| B.10 mL 0.02 mol·L-1 HCl溶液与10 mL 0.02 mol·L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12 |
| C.0.1 mol/L的Na2S溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S) |
| D.pH=3的一元酸和pH=11的一元碱等体积混和后的溶液中一定是c(OH-)=c(H+) |
关于常温下pH=2的醋酸溶液,下列叙述正确的是
| A.c(CH3COOH)=0.01mol·L-1 |
| B.c(H+)=c(CH3COO-) |
| C.加水稀释100倍后,溶液pH=4 |
| D.醋酸的电离常数为Ka,CH3COO-的水解常数为Kh,则Ka·Kh=Kw |
下列有关说法正确的是
| A.常温下,0.1 mol/L NH4Cl溶液加蒸馏水稀释,溶液的pH不断增大,但无限接近7 |
| B.25 ℃时,溶液中水电离出的c(H+)和水电离出的c(OH-)的乘积一定等于10-14 |
| C.pH=6的纯水中,c(OH-)=10-8 mol·L-1 |
| D.稀释0.01 mol·L-1的醋酸溶液时,溶液中所有的离子浓度均减小 |