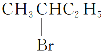题目内容
【题目】下表是元素周期表的一部分,请回答有关问题:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为 ______________。
(2)表中元素能形成两性氢氧化物的化学式___________,写出⑦元素的单质与⑨最高价氧化物的水化物反应的离子方程式 ______。
(3)④元素与⑦元素形成化合物的电子式 ___________。
(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是(填化学式)_____________。
(5)③元素与⑩元素两者核电荷数之差是 _________。
(6)水溶液中⑦的单质可以将⑩的简单离子置换为其单质,写出该反应的离子方程式_______。
【答案】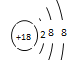 Al(OH)3 Cl2 + 2OH- = Cl- + ClO- + H2O
Al(OH)3 Cl2 + 2OH- = Cl- + ClO- + H2O 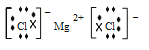 HClO4 26 Cl2 + 2Br- =2Cl- + Br2
HClO4 26 Cl2 + 2Br- =2Cl- + Br2
【解析】
根据元素在周期表中的位置知,①~⑩种元素分别是C、N、F、Mg、Al、S、Cl、Ar、K、Br元素。结合元素周期律和物质的性质分析解答。
(1)这些元素中最不活泼的元素是Ar,其原子核外有18个电子,核外有3个电子层,其原子结构示意图为![]() ;
;
(2)表中能形成两性氢氧化物的元素是铝,形成两性氢氧化物的化学式为Al(OH)3;⑨最高价氧化物的水化物是KOH,⑦元素的单质Cl2和KOH溶液反应生成氯化钾、次氯酸钾和水,反应的离子方程式为Cl2 + 2OH-= Cl- + ClO- + H2O;
(3)④是Mg,⑦是Cl,两种元素形成的化合物MgCl2是离子化合物;Mg2+与Cl-通过离子键结合,电子式为![]() ;
;
(4)①、②、⑥、⑦四种元素分别是C、N、S、Cl,四种元素最高价氧化物对应的水化物的酸性最强的是HClO4;
(5)③元素与⑩元素两者核电荷数之差=35-9=26。
(6) 水溶液中⑦的单质Cl2可以将⑩的简单离子Br-置换为其单质Br2,反应的离子方程式为Cl2 + 2Br- =2Cl- + Br2。

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案【题目】乙苯(![]() )、苯乙烯(
)、苯乙烯(![]() )均是重要的有机溶剂和工业原料。
)均是重要的有机溶剂和工业原料。
已知:①![]() (g)+HCl(g)
(g)+HCl(g)![]()
![]() (g) △H1= 54 kJmol1
(g) △H1= 54 kJmol1
②H2(g)+Cl2(g)=2HCl(g) △H2=185 kJmol1
③![]() (g)+Cl2(g)
(g)+Cl2(g)![]()
![]() (g)+HCl(g) △H3=118kJmol1
(g)+HCl(g) △H3=118kJmol1
④相关化学键的键能数据如表所示:
化学键 | CH | CC | C=C | CCl | HCl |
键能/(kJmol1) | 412 | 348 | x | 341 | 432 |
请回答:
(1)x=___;
(2)![]() (g)+H2(g)
(g)+H2(g)![]() (g) △H4
(g) △H4
①△H4=___。
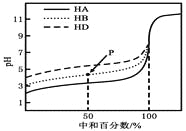
②上述反应中,![]() 的平衡转化率α与温度(T)和压强(P)的关系如图所示。则:
的平衡转化率α与温度(T)和压强(P)的关系如图所示。则:
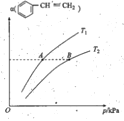
I.A、B两点的平衡常数:K(A)___K(B)(填“大于”、“小于”或“等于”)。
II.A、B两点的正反应速率:v(A)___v(B)(填“大于”、“小于”或“等于”)。
(3)工业中用乙苯(C6H5-CH2CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6H5-CH=CH2)。向体积为VL的恒容容器中充入amol乙苯,压强为1×106Pa,在600℃时,平衡体系中苯乙烯的物质的量分数为25%,则:
①乙苯的平衡转化率为___;
②此温度下乙苯催化脱氢的方法制取苯乙烯的平衡常数Kp=___Pa;
③实际生产的反应在常压下进行,且向乙苯蒸气中掺入水蒸气,利用热力学数据计算得到温度和投料比对乙苯转化率的影响可用图表示。[M=n(H2O)/n(乙苯]
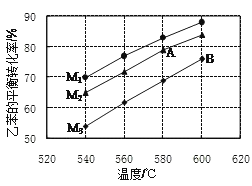
a.图中投料比(M1、M2、M3)的大小顺序为___;
b.随着反应的进行,催化剂上的少量积炭使其活性减弱,水蒸气有助于恢复催化剂的活性,原因是___(用化学方程式表示)。