题目内容
在反应2SO 2(g)+O 2(g)=2SO 3(g)△H<0,达到平衡后如果其它条件不变时,分别改变下列条件,对化学平衡有什么影响?说明理由.
(1)增加压强
(2)增加O 2 浓度
(3)减小SO 3浓度
(4)升高温 度
(5)使用催化剂
(1)增加压强
正方向移动
正方向移动
;理由:正方向为计量数减小的方向
正方向为计量数减小的方向
.(2)增加O 2 浓度
正方向移动
正方向移动
;理由:增加反应物浓度,平衡向正方向移动
增加反应物浓度,平衡向正方向移动
.(3)减小SO 3浓度
正方向移动
正方向移动
;理由:减少生成物浓度,平衡向正方向移动
减少生成物浓度,平衡向正方向移动
.(4)升高温 度
逆方向移动
逆方向移动
;理由:该反应正方向为放热反应
该反应正方向为放热反应
.(5)使用催化剂
不移动
不移动
;理由:催化剂对平衡无影响
催化剂对平衡无影响
.分析:根据外界条件对平衡的影响分析:增大压强向计量数增大的方向移动;增加反应物或减少生成物向正方向移动;升高温度向吸热方向移动;加入催化剂,平衡不移动.
解答:解:(1)正方向为计量数减小的方向,所以增加压强向正方向;故答案为:正方向;正方向为计量数减小的方向;
(2)增加反应物浓度,平衡向正方向移动,所以增加氧气的浓度,平衡向正方向移动,故答案为:正方向移动;增加反应物浓度,平衡向正方向移动.
(3)减少生成物向正方向移动,所以减少SO 3浓度,平衡向正方向移动;故答案为:正方向移动;减少生成物浓度,平衡向正方向移动;
(4)升高温度向吸热方向移动,该反应正方向为放热反应,所以升高温度向逆方向移动,故答案为:逆方向移动;该反应正方向为放热反应.
(5)催化剂对平衡无影响,所以加入催化剂平衡不移动,故答案为:不移动;催化剂对平衡无影响.
(2)增加反应物浓度,平衡向正方向移动,所以增加氧气的浓度,平衡向正方向移动,故答案为:正方向移动;增加反应物浓度,平衡向正方向移动.
(3)减少生成物向正方向移动,所以减少SO 3浓度,平衡向正方向移动;故答案为:正方向移动;减少生成物浓度,平衡向正方向移动;
(4)升高温度向吸热方向移动,该反应正方向为放热反应,所以升高温度向逆方向移动,故答案为:逆方向移动;该反应正方向为放热反应.
(5)催化剂对平衡无影响,所以加入催化剂平衡不移动,故答案为:不移动;催化剂对平衡无影响.
点评:本题考查了外界条件对平衡的影响,考查学生对基础知识的掌握情况,难度不大.

练习册系列答案
相关题目
 4C(g)
△H>0达到平衡时,c(A)=2mol/L,c(B)=7mol/L,c(c)
4C(g)
△H>0达到平衡时,c(A)=2mol/L,c(B)=7mol/L,c(c)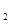 (g)
(g) 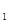 与K
与K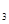 的平衡常数K=19。在该温度下的体积
的平衡常数K=19。在该温度下的体积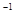 c0(O
c0(O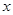 kJ·mol
kJ·mol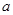 +b>
+b>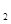 (g)的平衡常数为K1;H
(g)的平衡常数为K1;H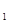 与K
与K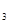 的平衡常数K=19。在该温度下的体积
的平衡常数K=19。在该温度下的体积 容包括:化学平衡、电离平衡、水解平衡和
容包括:化学平衡、电离平衡、水解平衡和 4C(g) △H>0达到平衡时,c(A)=2mol/L,c(B)=7mol/L,c(c)
4C(g) △H>0达到平衡时,c(A)=2mol/L,c(B)=7mol/L,c(c)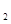 (g)
(g) 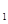 与K
与K 的平衡常数K=19。在该温度下的体积
的平衡常数K=19。在该温度下的体积 c0(O
c0(O
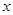 kJ·mol
kJ·mol +b>
+b>