题目内容
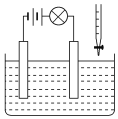
【题目】某汽车尾气分析仪以燃料电池为工作原理测定CO的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NAMCON中自由移动。下列说法中正确的是( )

A.传感器中通过的电流越大,CO的含量越低
B.工作时电子由电极a通过固体介质NAMCON流向电极b
C.工作时电极b作正极,电流由电极a流向电极b
D.当固体电解质中有1 mol O2-通过时,电子转移2 mol
【答案】D
【解析】
试题分析:A.一氧化碳的含量越大,原电池放电时产生的电流越大,故A错误;B.该装置是原电池,通入一氧化碳的电极a是负极,通入空气的电极是正极,原电池放电时,电子从负极a通过传感器流向电极b,故B错误;C.工作时电极b作正极,O2-由电极b流向电极a,故C错误;D.该装置是原电池,通入一氧化碳的电极a是负极,负极上一氧化碳失电子发生氧化反应,电极反应式为:CO+O2--2e-═CO2,当固体电解质中有1 mol O2-通过时,电子转移2 mol,故D正确;故选D。

练习册系列答案
相关题目
【题目】T℃时,体积均为0.5L的两个恒容密闭容器中发生可逆反应:2A(g)+B(g) ![]() 2C(g)△H=-QkJ/mol(Q>0)。保持温度不变,实验测得起始和平衡时的有关数据如下表:
2C(g)△H=-QkJ/mol(Q>0)。保持温度不变,实验测得起始和平衡时的有关数据如下表:
容器 编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
A | B | C | ||
① | 2 | 1 | 0 | 放热 0.75QkJ |
② | 0.4 | 0.2 | 1.6 | |
下列叙述中正确的是( )
A. 容器①、②中反应的平衡常数均为4
B. 容器②中达到平衡时放出的热量为0.05QkJ
C. 向容器①中通入氦气,平衡时A的转化率不变
D. 其他条件不变,若容器②保持恒容绝热,则达到平衡时C的体积分数小于2/3