题目内容
7. 可用如图所示装置制取少量乙酸乙酯(酒精灯等在图中均已略去).请填空:
可用如图所示装置制取少量乙酸乙酯(酒精灯等在图中均已略去).请填空:(1)试管a中需加入浓硫酸、冰醋酸和乙醇各2mL,正确的加入顺序用操作是先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,再加冰醋酸.
(2)为防止a中的液体在实验时发生暴沸,在加热前应采取的措施是在试管a中加入几粒沸石.
(3)实验中加热试管a的目的是:加快反应速率;及时将产物乙酸乙酯蒸出,以利于平衡向生成乙酸乙酯的方向移动.
(4)试管b中加有饱和Na2CO3溶液,其作用是吸收随乙酸乙酯蒸出的少量酸性物质和乙醇.
(5)反应结束后,振荡试管b,静置.反应结束后,试管B内的液体分成两层,乙酸乙酯在上层层(填写“上”或“下”).若分离10mL该液体混合物需要用到的主要玻璃仪器是分液漏斗.
分析 (1)浓硫酸密度大,应将浓硫酸加入到乙醇中,以防酸液飞溅,乙酸易挥发,冷却后再加入乙酸;
(2)液体加热要加碎瓷片,防止暴沸;
(3)实验中加热试管的目的提供能量;
(4)饱和碳酸钠溶液与乙酸反应除去乙酸、同时降低乙酸乙酯的溶解度,便于分层;
(5)乙酸乙酯是难溶于水的液体,密度小于水;分离互不相溶的液体用分液漏斗.
解答 解:(1)为防止酸液飞溅,应将密度大的液体加入到密度小的液体中,乙酸易挥发,冷却后再加入乙酸,
故答案为:先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,再加冰醋酸;
(2)液体乙酸乙醇沸点低,加热要加碎瓷片,防止暴沸,
故答案为:在试管a中加入几粒沸石;
(3)实验中加热试管,反应的温度高,反应速度快,该反应为可逆反应,温度高,乙酸乙酯的沸点低,易挥发,所以化学平衡向正反应方向移动,利于生成乙酸乙酯,
故答案为:加快反应速率;及时将产物乙酸乙酯蒸出,以利于平衡向生成乙酸乙酯的方向移动;
(4)制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯,
故答案为:吸收随乙酸乙酯蒸出的少量酸性物质和乙醇;
(5)乙酸乙酯是难溶于水的液体,密度小于水,会漂浮在水的上面,则分层时在上层;分离互不相溶的液体用分液漏斗;
故答案为:上层;分液漏斗.
点评 本题考查了乙酸乙酯的制备,解答时须注意酯化反应的原理和饱和碳酸钠溶液的作用,题目难度不大,试题培养了学生灵活应用所学知识的能力及化学实验能力.

练习册系列答案
 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
17.下列各组物质中,一定量的气体X和一定量的气体Y同时通入盛有溶液Z的洗气瓶中,最终肯定有沉淀生成的是(空气不参与反应)( )
| A. | X-NH3 Y-SO2 Z-BaCl2 | B. | X-NO2 Y-SO2 Z-BaCl2 | ||
| C. | X-HCl Y-CO2 Z-Ca(OH)2 | D. | X-CO2 Y-SO2 Z-CaCl2 |
18.下列实验方案中,合理的是( )
| A. | 分离木炭粉和CuO:在空气中充分灼烧 | |
| B. | 验证质量守恒定律:比较镁条燃烧前后固体质量 | |
| C. | 制备Fe(OH)3:向FeCl3溶液中加入NaOH溶液,过滤、洗涤、干燥 | |
| D. | 除去CO2中的HCl和水蒸气:依次通过过量的NaOH溶液、浓硫酸 |
15.以下化学用语正确的是( )
| A. | 羟基的电子式: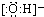 | B. | 乙醇的结构式CH3CH2OH | ||
| C. | 乙烷的结构简式CH3CH3 | D. | 聚丙烯的结构简式: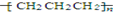 |
2.用铂电极电解CuSO4和KNO3的混合溶液500mL,经过一段时间后,两极均得到标准状况下11.2L的气体,则原混合溶液中CuSO4的物质的量浓度为( )
| A. | 0.5 mol•L-1 | B. | 0.8 mol•L-1 | C. | 1.0 mol•L-1 | D. | 1.5 mol•L-1 |
12.下列各物质无论以何种比例混合,其氯元素的质量分数不变的是( )
| A. | HClO4、KClO3 | B. | KClO、KCl | C. | NaClO、KCl | D. | NaCl、KCl |
19.设NA代表阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,4.0 g CH4中含有共价键的数目为NA | |
| B. | 常温常压下,6.4 g氧气和臭氧中含有的分子总数为0.2NA | |
| C. | 0.3 mol•L-1的NH4NO3溶液中含有的NO3-数目为0.3NA | |
| D. | 一定条件下6.4g SO2与足量氧气反应生成SO3,转移电子数为0.2NA |
16.下列化学用语正确的是( )
| A. | 乙烯的结构简式:CH2CH2 | B. | 次氯酸的结构式:H-Cl-O | ||
| C. | ${\;}_{8}^{18}$O原子结构示意图: | D. | NH${\;}_{4}^{+}$的电子式: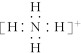 |
17.下列化学用语正确的是( )
| A. | 氮气的电子式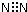 | B. | Mg2+的结构示意图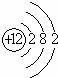 | ||
| C. | NH3的结构式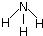 | D. | 过氧化钠的电子式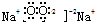 |