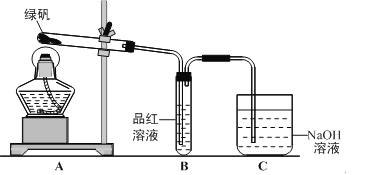
��Ŀ����
����Ŀ����1��0.5 mol CO2������Ϊ__________�ˣ����к���CO2����__________�����ڱ�״���µ������________����
��2������£�1.92 gij��������Ϊ672 mL������������Է�������Ϊ__________��
��3��NaNO2����ۺ�ʳ�����ƣ�������ζ������ʹ����ʳ�ж���
��֪NaNO2�ܷ������·�Ӧ��2NaNO2��4HI��2NO����I2��2NaI��2H2O���÷�Ӧ����������_______�����ݸ÷�Ӧ������NaNO2��NaCl����ѡ�õ������У���ʳ�ס��ڵ⻯�ص�����ֽ���۵��ۡ��ܰƣ�����Ϊ����ѡ�õ�������_______________(�����)��
��4��Ϊ��ȥ Fe���л��е�����Al�ۣ�����ѡ�õ��Լ�Ϊ__________���ѧʽ�����䷴Ӧ�����ӷ���ʽ_________________��
��5��H2S��һ����ɫ���г�������ζ���ж��Ŀ�ȼ�����塣��30% FeCl3��Һ������Һ������H2S���壬�÷�Ӧ���ӷ���ʽΪ��__________________��
���𰸡� 22 0.5NA��3.01��1023 11.2 64 NaNO2 �٢� NaOH 2Al + 2OH- + 2H2O ===2AlO2- + 3H2�� 2Fe3+ + H2S �� S��+2Fe2+ + 2H+
����������1��0.5 molCO2������Ϊ��0.5mol��44g/mol=22g�����к���CO2����0.5mol��NA��/mol=0.5NA����0.5mol��6.02��1023=3.01��1023�����ڱ�״���µ������0.5mol��22.4L/mol=11.2L��
��2������£�672 mLij��������ʵ���Ϊ�� ![]() =0.03mol����������Ħ������Ϊ��
=0.03mol����������Ħ������Ϊ�� ![]() ������Է�������Ϊ64��
������Է�������Ϊ64��
��3����Ӧ2NaNO2��4HI��2NO����I2��2NaI��2H2O��NaNO2�ĵ�Ԫ�ػ��ϼ۽��ͣ�����NaNO2������������ˮ���۵��ۡ��ܰ���NaNO2������Ӧ����������������ѡ��KI��NaNO2��Ӧ����I2���������������²��ܷ�Ӧ��ʳ���������������ӣ��⻯����ʳ���е���������ӣ��������Ƶ���������������������ӷ�����Ӧ���ɵⵥ�ʣ�I2ʹʪ��ĵ��۵⻯����ֽ����������NaNO2��NaCl����ѡ��٢ڣ�
��4���������ܺ�����������Һ��Ӧ�����������ܣ��ʿ�ѡ������������Һ��ȥ Fe���л��е�����Al�ۣ��䷴Ӧ�����ӷ���ʽ�ǣ�2Al+2OH-+2H2O=2AlO2-+H2����
��5��FeCl3��Һ��H2S���巴Ӧ�������ʺ��Ȼ��������÷�Ӧ���ӷ���ʽΪ��2Fe3+ + H2S �� S��+2Fe2+ + 2H+��

 ������ϰ�ο����뵥Ԫ���ϵ�д�
������ϰ�ο����뵥Ԫ���ϵ�д�