题目内容
1.下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是( )| A. | 向稀盐酸中逐滴加入过量的NaAlO2溶液 | |
| B. | 向AlCl3溶液中逐滴加入过量稀NaOH溶液 | |
| C. | 向AgNO3溶液中逐滴加入稀氨水 | |
| D. | 向澄清石灰水中通入过量SO2 |
分析 根据复分解反应发生的条件及物质的溶解性来分析能够反应且“先产生沉淀,然后沉淀又溶解”,注意反应与量有关.
A、盐酸和偏铝酸钠反应生成的氢氧化铝是两性氢氧化物溶于强酸强碱;
B、氢氧化钠和氯化铝反应生成的氢氧化铝可溶于氢氧化钠溶液;
C、硝酸银和氨水反应生成的氢氧化银溶于过量的氨水生成银氨溶液;
D、二氧化硫和氢氧化钙反应生成亚硫酸钙沉淀,继续通入会沉淀溶解生成亚硫酸氢钙;
解答 解:A、盐酸和偏铝酸钠反应生成的氢氧化铝是两性氢氧化物溶于强酸强碱,向稀盐酸中逐滴加入过量的NaAlO2溶液,开始无沉淀生成,最后生成沉淀,故A符合;
B、氢氧化钠和氯化铝反应生成的氢氧化铝可溶于氢氧化钠溶液,向AlCl3溶液中逐滴加入过量稀NaOH溶液反应生成白色沉淀,继续滴入沉淀溶解,故B不符合;
C、硝酸银和氨水反应生成的氢氧化银溶于过量的氨水生成银氨溶液,向AgNO3溶液中逐滴加入稀氨水先生成氢氧化银白色沉淀,继续滴加白色沉淀消失,故C不符合;
D、二氧化硫和氢氧化钙反应生成亚硫酸钙沉淀,继续通入会沉淀溶解生成亚硫酸氢钙,向澄清石灰水中通入过量SO2,先生成白色沉淀,继续滴加白色沉淀消失,故D不符合;
故选A.
点评 本题考查了物质性质的分析判断,反应产物和反应现象的理解应用是解题关键,注意反应过程中物质量的分析,掌握基础是关键,题目难度中等.

练习册系列答案
 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
12.下列叙述正确的是( )
| A. | 在碱金属元素中,所有碱金属的氧化物均属于碱性氧化物 | |
| B. | 由于钠、钾的密度都小于1,所以,碱金属单质的密度都小于1 | |
| C. | 金属锂不能保存于煤油中,金属钾可以保存于煤油中 | |
| D. | 碱金属元素单质的熔点按Li、Na、K、Rb、Cs顺序递增,密度也递增 |
9.下列说法中错误的是( )
| A. | C4H10表示纯净的丁烷 | |
| B. | 在相同条件下,燃烧等物质的量的C2H4和乙醇,消耗O2体积相同 | |
| C. | 相对分子质量相同的两种物质一定是同分异构体 | |
| D. | 烯烃各同系物中碳的质量分数都相等 |
13.甲苯和苯相比较,下列叙述中正确的是( )
| A. | 都是芳香烃 | B. | 都不能发生取代反应 | ||
| C. | 都能使KMnO4酸性溶液褪色 | D. | 苯环上都只有一种一氯代物 |
10.下列各组中化合物的性质比较,不正确的是( )
| A. | 酸性:HClO4>HBrO4>HIO4 | B. | 碱性:Ba(OH)2>Ca(OH)2>Mg(OH)2 | ||
| C. | 稳定性:SiH4>PH3>H2S | D. | 非金属性:F>O>S |
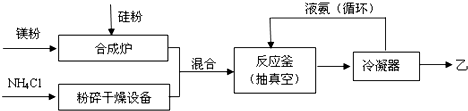
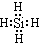 ;比较热稳定性:乙<NH3(填>,<或=).
;比较热稳定性:乙<NH3(填>,<或=).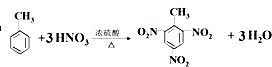

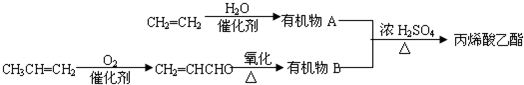
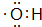 .
.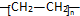 .
.