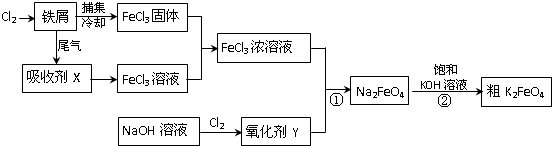
题目内容
7.怎么用乙烯制备乙二酸乙酯?化学方程式.分析 乙烯为原料可合成乙二酸二乙酯,要先制得乙醇和乙二酸,乙二酸可由乙烯通过加成、水解、氧化制得,乙醇可由乙烯与水加成制得,据此写出化学方程式.
解答 解:以乙醇为原料合成乙二酸乙二酯,
经过以下几步第一步:乙烯与溴发生加成反应生成1,2-二溴乙烷,方程式:CH2=CH2+Br2→CH2BrCH2Br;
第二步:1,2-二溴乙烷水解生成乙二醇,方程式:CH2BrCH2Br+2NaOH$→_{△}^{水}$CH2OHCH2OH+2NaBr;
第四步:乙二醇氧化生成乙二酸,方程式:CH2OHCH2OH+2O2$\stackrel{一定条件下}{→}$HOOC-COOH+2H2O;
第五步:HOCH2CH2OH与乙二酸发生酯化反应生成环状化合物的化学方程式为: ,
,
故答案为:CH2=CH2+Br2→CH2BrCH2Br;CH2BrCH2Br+2NaOH$→_{△}^{水}$CH2OHCH2OH+2NaBr;CH2OHCH2OH+2O2$\stackrel{一定条件下}{→}$HOOC-COOH+2H2O; .
.
点评 本题为有机合成题,明确物质的结构及性质是解题关键,注意方程式书写的注意问题,题目难度不大.

练习册系列答案
相关题目
17.钠与下列物质反应,产物唯一的是( )
| A. | 盐酸 | B. | 氯化铜溶液 | C. | Cl2 | D. | O2 |
19.下列叙述中正确的是( )
| A. | 1mol H2与0.5mol H2和O2的混合物所含的原子数目相同 | |
| B. | 32g O2含有6.02×1023个氧分子 | |
| C. | 1mol H2O中含有2mol H2,1mol O,总共所含电子的物质的量为10mol | |
| D. | 物质的量为1mol 的任何微粒的质量与NA个该种微粒的质量在任何情况下都相等 |
16.吸烟对人体危害极大,香烟燃烧产生大量污染物,如表为某品牌香烟烟雾中各物质的含量.
(1)其中有害物质的含量大于(大于或小于)10%,尼古丁是无色油状液体,大量存在香烟烟雾中,说明其具有易挥发的性质;
(2)表中物质,能与血红蛋白结合的是CO,有芳香气味,常做溶剂但有致癌作用的烃是苯,既与酸雨的形成有关,也与光化学烟雾的形成有关的是NO2.
| 物质 | CO | CO2 | C2H6 | NOx | 焦油 | 尼古丁 | 甲醛 | 苯 |
| 含量 (mg/支) | 17 | 60 | 0.6 | 0.6 | 35 | 2.5 | 0.05 | 0.1 |
(2)表中物质,能与血红蛋白结合的是CO,有芳香气味,常做溶剂但有致癌作用的烃是苯,既与酸雨的形成有关,也与光化学烟雾的形成有关的是NO2.
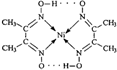 由于受3d电子的影响,元素周期表中第四周期过渡元素的明显特征是形成多种多样的配合物.
由于受3d电子的影响,元素周期表中第四周期过渡元素的明显特征是形成多种多样的配合物.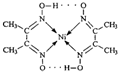 分子内的作用力没有B (填编号).
分子内的作用力没有B (填编号). 2:1.
2:1.