题目内容
【题目】与下列事实对应的化学用语不正确的是( )
A.用热的纯碱溶液可以清洗油污:CO32﹣+H2O?HCO3﹣+OH﹣
B.配制FeSO4溶液时加入适量的铁粉:Fe3++Fe═2Fe2+
C.向NH4HSO4溶液中加过量的NaOH溶液并加热:NH4++H++2OH﹣ ![]() NH3↑+2H2O
NH3↑+2H2O
D.铝片溶于较浓的NaOH溶液中,产生气体:2Al+2OH﹣+2H2O═2AlO2﹣+3H2↑
【答案】B
【解析】解:A.用热的纯碱溶液可以清洗油污,碳酸根离子水解生成碳酸氢根和氢氧根:CO32﹣+H2OHCO3﹣+OH﹣ , 故A正确; B.配制FeSO4溶液时加入适量的铁粉,离子方程式:2Fe3++Fe═3Fe2+ , 故B错误;
C.向NH4HSO4溶液中加过量的NaOH溶液并加热:NH4++H++2OH﹣ ![]() NH3↑+2H2O,故C正确;
NH3↑+2H2O,故C正确;
D.铝片溶于较浓的NaOH溶液中,产生气体,离子方程式:2Al+2OH﹣+2H2O═2AlO2﹣+3H2↑,故D正确;
故选:B.

【题目】某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响,在常温下按照如下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol L-1 FeCl3溶液 |
④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol L-1 FeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol L-1 FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是__________________________。
(2)实验①和②的目的是_____________________。实验时由于较长时间没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是_____________________。
(3)写出实验③的化学反应方程式:______________。
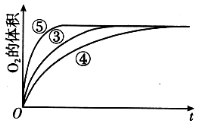
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。分析如图能够得出的实验结论是____________________________。