题目内容
13.对化学平衡移动的分析,下列说法正确的是( )| A. | 已达平衡的反应C(s)+H2O(g)?CO(g)+H2(g),当增加反应物的物质的量时,平衡一定向正反应方向移动 | |
| B. | 已达平衡的反应N2(g)+3H2(g)?2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高 | |
| C. | 改变外界条件使正反应速率大于逆反应速率时,化学平衡一定向正反应方向移动 | |
| D. | 已达平衡的反应N2(g)+3H2(g)?2NH3(g),在恒压反应器中充入稀有气体,平衡不移动 |
分析 A、如增大固体的量,平衡不移动;
B、当增大N2的物质的量,N2的转化率减小;
C、改变外界条件使正反应速率大于逆反应速率时,化学平衡向正反应方向移动;
D、在恒压反应器中充入稀有气体,反应物的浓度改变,平衡可能移动.
解答 解:A、C为固体,增大固体的量,平衡不移动,故A错误;
B、增大N2的物质的量,平衡向正反应方向移动,但转化的少,增加的多,N2的转化率减小,故B错误;
C、改变外界条件使正反应速率大于逆反应速率时,化学平衡向正反应方向移动,故C正确;
D、在恒压反应器中充入稀有气体,气体反应物与生成物化学计量数之和不相等,平衡移动,故D错误.
故选C.
点评 本题考查化学平衡的影响因素,题目难度中等,注意把握影响化学平衡的因素,易错点为CD,注意体会.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案
相关题目
8.氮化硅(Si3N4,其中N元素化合价为-3)是一种具有耐高温、熔融态时不导电等优异性能的新型陶瓷.工业上可用下列方法制取:3SiO2+6C+2N2$\frac{\underline{\;高温\;}}{\;}$ Si3N4+6CO.下列说法不正确的是( )
| A. | 上述反应中,Si元素化合价不变 | B. | 氮化硅晶体中含有Si4+ | ||
| C. | Si3N4属于氮化物 | D. | 上述反应属于氧化还原反应 |
18.下列过程中属于△H小于零的反应的是( )
| A. | 氯酸钾分解 | B. | 氢气还原氧化铜 | ||
| C. | 浓硫酸的稀释 | D. | 铝片与浓盐酸的反应 |

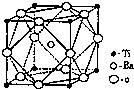 钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”.试回答下列问题:
钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”.试回答下列问题: