题目内容
【题目】(一)雾霾天气肆虐给人类健康带来了严重影响.燃煤和汽车尾气是造成空气污染的原因之一.
(1)汽车尾气净化的主要原理为:2NO(g)+2CO![]() 2CO2(g)+N2(g)△H<O
2CO2(g)+N2(g)△H<O
①反应的速率-时间图像如图甲所示.若其他条件不变,仅在反应前加入合适的催化剂,其速率时间图象如图乙所示.以下说法正确的是___________(填对应字母).
![]()
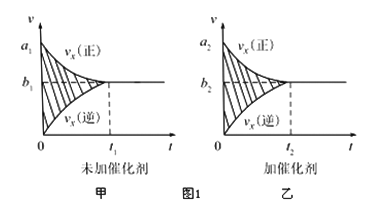
A.a1>a2 B.b1<b2 C.t1>t2
D.图乙中阴影部分面积更大 E.图甲中阴影部分面积更大
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是_________(填代号)
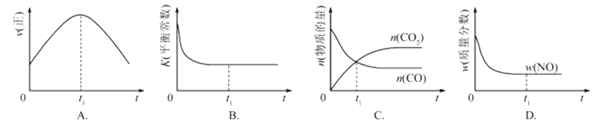
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题.煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.
已知:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ/mol
N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ/mol
2NO2(g)![]() N2O4(g)△H=﹣56.9kJ/mol H2O(g)=H2O(l)△H=﹣44.0kJ/mol
N2O4(g)△H=﹣56.9kJ/mol H2O(g)=H2O(l)△H=﹣44.0kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:______________.
(3)CH4和H2O(g) 在催化剂表面发生反应CH4+H2OCO+3H2,该反应在不同温度下的化学平衡常数如表:
温度/℃ | 800 | 1000 | 1200 | 1400 |
平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
①该反应是_________反应(填“吸热”或“放热”).
②T℃时,向1L密闭容器中投入l mol CH4和l mol H2O(g),平衡时c(CH4)=0.5mol/L,该温度下反应CH4+H2O![]() CO+3H2的平衡常数K=______________.
CO+3H2的平衡常数K=______________.
(二)恒温时,将2molA和2molB气体投入固定容积为2L密闭容器中发生反应:2A(g)+B(g) ![]() xC(g)+D(s),10s时,测得A的物质的量为1.7mol,C的反应速率为0.0225mol·L—1·s—1;40s时反应恰好处于平衡状态,此时B的转化率为20%。请填写下列空白:
xC(g)+D(s),10s时,测得A的物质的量为1.7mol,C的反应速率为0.0225mol·L—1·s—1;40s时反应恰好处于平衡状态,此时B的转化率为20%。请填写下列空白:
(1)x=____________
(2)从反应开始到10s,B的平均反应速率为____________
(3)从反应开始到40s达平衡状态,A的平均反应速率为____________
(4)平衡时容器中B的体积分数为____________
(5)下列各项能表示该反应达到平衡状态是____________
A.消耗A的物质的量与生成D的物质的量之比为2∶1
B.容器中A、B的物质的量 n(A)∶n(B) =2∶1
C.气体的平均相对分子质量不再变化
D.压强不再变化
E.气体密度不再变化
【答案】BCBDCH4(g)+N2O4(g)═N2(g)+2H2O(l)+CO2(g)△H=﹣898.1kJ/mol吸热6.7530.0075mol/(L·s)0.01mol(L·s)—140%CE
【解析】(一)本题考查速率-时间图象的分析,化学平衡状态的判断热化学方程式的书写,化学平衡常数影响因素及计算等知识,题目难度较大,试题涉及的知识点较多,注意掌握化学平衡常数的概念、表达式及其影响因素,明确化学平衡状态判断的依据。
(1)①加入催化剂,正逆反应速率都增大,达到平衡所用时间较少,但平衡不移动,则图象阴影部分面积不变,答案为BC。
②A.到达平衡后正、逆速率相等,不再变化,t1时刻正反应速率最大,之后随反应进行速率发生变化,未到达平衡,A项错误;B.该反应正反应为放热反应,随反应进行温度升高,化学平衡常数减小,到达平衡后,温度不变,平衡常数不变,图象与实际符合,B项正确;C.t1时刻后二氧化碳、CO的物质的量发生变化,t1时刻未到达平衡状态,C项错误;D.NO的质量分数为定值,t1时刻处于平衡状态,D项正确,答案选BD。(2)已知:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ/mol ①、2NO2(g)
N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ/mol ①、2NO2(g)![]() N2O4(g)△H=﹣56.9kJ/mol、②H2O(g)=H2O(l)△H=﹣44.0kJ/mol③,根据盖斯定律,①-②+④×2可得CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O △H=-867kJ/mol-(-56.9kJ/mol)+2(-44.0)kJ/mol=-898.1kJ/mol, 即CH4催化还原N2O4(g)生成N2和H2O的热化学方程式为CH4(g)+N2O4(g)═N2(g)+2H2O(l)+CO2(g)△H=﹣898.1kJ/mol 。(3)①温度升高,平衡常数增大,即平衡向正反应方向移动,则该反应为吸热反应。②T℃时,向1L密闭容器中投入1molCH4和1mol H2O(g),平衡时c(CH4)=0.5molL-1,水蒸气的浓度为0.5molL-1,CO的浓度为0.5molL-1,氢气的浓度为1.5molL-1,该温度K=(0.5×1.5×1.5×1.5)÷(0.5×0.5)=6.75。
N2O4(g)△H=﹣56.9kJ/mol、②H2O(g)=H2O(l)△H=﹣44.0kJ/mol③,根据盖斯定律,①-②+④×2可得CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O △H=-867kJ/mol-(-56.9kJ/mol)+2(-44.0)kJ/mol=-898.1kJ/mol, 即CH4催化还原N2O4(g)生成N2和H2O的热化学方程式为CH4(g)+N2O4(g)═N2(g)+2H2O(l)+CO2(g)△H=﹣898.1kJ/mol 。(3)①温度升高,平衡常数增大,即平衡向正反应方向移动,则该反应为吸热反应。②T℃时,向1L密闭容器中投入1molCH4和1mol H2O(g),平衡时c(CH4)=0.5molL-1,水蒸气的浓度为0.5molL-1,CO的浓度为0.5molL-1,氢气的浓度为1.5molL-1,该温度K=(0.5×1.5×1.5×1.5)÷(0.5×0.5)=6.75。
(二)本题考查化学反应速率的计算、化学平衡的有关计算、化学平衡状态的判断等知识。注意三段式解题法的理解运用,全面掌握基础知识。
(1)根据题给信息可知,10s时A的物质的量变化量△n(A)=2mol-1.7mol=0.3mol,△n(C)=0.0225molL-1s-1×10s×2L=0.45mol,根据物质的量变化量之比等于化学计量数之比,则0.3mol:0.45mol=2:x,解得x=3。
(2)10s时,A反应了0.3mol,则B反应了0.15mol,所以从反应开始到10s,B的平均反应速率为0.15mol÷(2L×10s)=0.0075mol/(L·s)。
(3)40s时反应恰好处于平衡状态,此时B的转化率为20%,参加反应的B的物质的量为2mol×20%=0.4mol,由方程式可知,参加反应的A的物质的量为2×0.4mol=0.8mol,则v(A)=0.8mol÷(2L×40s)=0.01mol(L·s)—1 。
(4)40s时反应恰好处于平衡状态,此时B的转化率为20%,参加反应的B的物质的量为2mol×20%=0.4mol,由方程式可知,参加反应的A的物质的量为2×0.4mol=0.8mol,根据三段式列式为:2A(g)+B(g)3C(g)+D(s),
开始(mol):2 2 0 0
变化(mol):0.8 0.4 1.2 0.4
平衡(mol):1.2 1.6 1.2 0.4
平衡时B的体积分数为1.6mol÷(1.2mol+1.6mol+1.2mol)×100%=40%。
(5)A.消耗A的物质的量与生成D的物质的量之比为2:1,都表示反应正向进行,A项错误;B.容器中A、B的物质的量n(A):n(B)=2:1,不能表示正逆反应速率相同,B项错误;C.反应前后气体的质量发生变化,气体的物质的量不变,气体的平均相对分子质量不再变化,说明反应正逆反应速率相同,C项正确;D.该反应是气体体积不变的反应,压强不再变化不能说明反应达到平衡,D项错误;E.密度等于气体质量除以气体体积,反应前后气体体积不变,反应中生成的D是固体,气体密度不再变化说明反应达到平衡,E项正确。答案选CE。