题目内容
下列各组物质中,不能按左下图所示(“→”表示一步完成)关系相互转化的是
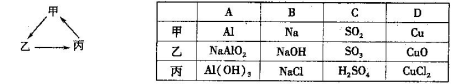

A
试题分析:A、铝溶于氢氧化钠溶液生成偏铝酸钠,偏铝酸钠溶于酸生成氢氧化铝,但氢氧化铝不能直接转化为铝,A不正确;B、钠溶于水生成氢氧化钠,氢氧化钠溶于酸生成氯化钠,电解熔融的氯化钠生成钠,B正确;C、SO2被氧化生成三氧化硫,三氧化硫溶于水生成硫酸,浓硫酸被还原可以生成二氧化硫,C正确;D、铜与氧气反应生成氧化铜,氧化铜溶于盐酸生成氯化铜,电解氯化铜得到金属铜,D正确,答案选A。

练习册系列答案
相关题目
 乙+丙 b.乙
乙+丙 b.乙 氧化物+H2O
氧化物+H2O 丙。则:
丙。则:
 Q
Q Q溶液
Q溶液 M+N
M+N