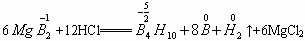题目内容
配平下列化学反应方程式(1) □Mg+□HNO3 (极稀) == □Mg(NO3)2+ □NH4NO3 +□H2O
(2) □SO2+□Cl2+□H2O==□HCl+□H2SO4
(3) □KMnO4+□HCl(浓)== □KCl+□MnCl2+□H2O+□Cl2↑
(4) □NH3+□O2==□NO+□H2O
(5) □FeS2+□O2==□Fe2O3+□SO2
难点提示:FeS2中两种元素的化合价均发生变化。
(6) □S +□KNO3 +□C==□K2S+□CO2↑+□N2↑
(7) □Na2O2+□HCl==□NaCl+□H2O+□O2↑
难点提示:1mol O22-中只有1mol转移。
(8) □Fe2++□Br2== □Fe3++□Br-
(9) □C+□H2SO4(浓)== □SO2↑+□CO2↑+□H2O
(10)□Fe3O4+□K2Cr2O7+□H2SO4==□Fe2(SO4)3+□K2SO4+□Cr2(SO4)3+□H2O
难点提示:将Fe3O4看成FeO·Fe2O3,则1mol Fe3O4中只有1molFeO失去1mol电子。
解析:
| (1) 4 10 4 1 3 ; (2) 1 1 2 2 1
(3) 2 16 2 2 8 5 ; (4) 4 5 4 6 (5) 4 11 2 8 (6) 1 2 3 1 3 1 (7) 2 4 4 2 1 (8) 2 1 2 2 (9) 1 2 2 1 2 (10) 6 1 31 9 1 1 31
|
提示:
| 在氧化还原反应中原子间得失电子的总数相等,具体表现在元素化合价上升和下降的绝对值相等。据此可通过电子转移或化合价升降来配平氧化还原反应方程式。
例如:□Mg+□HNO3 (极稀) == □Mg(NO3)2+ □NH4NO3 +□H2O的配平。 ①列式: ②标价: ③交叉:根据电子得失相等的原理或化合价上升和下降的绝对值相等的原则,先确定氧化剂和还原剂化学式前面的系数,再确定相应产物的系数;
④核对:核对方程式两边各元素的原子个数、确定其他物质的系数,化简。
|