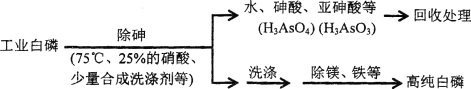
题目内容
【题目】下列反应既是氧化还原反应,又是吸热反应的是
A.灼热的炭与CO2反应 B.铝片与稀H2SO4反应
C.Ba(OH)2·8H2O与NH4Cl的反应 D.甲烷在O2中的燃烧反应
【答案】A
【解析】
试题分析:灼热的炭与CO2反应,有化合价的变化属于氧化还原反应,且属于吸热反应,A选;B.铝片与稀H2SO4反应,有化合价的变化属于氧化还原反应,但属于放热反应,B不选;C.Ba(OH)28H2O与NH4Cl的反应为吸热反应,但不属于氧化还原反应,C不选;D.甲烷在O2中的燃烧反应,有化合价的变化属于氧化还原反应,但属于放热反应,D不选;答案选A。

【题目】(1) 常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A,根据题意回答下列问题:
①写出酸H2A的电离方程式__________________。
②若溶液M由10mL 2 mol·L-1NaHA溶液与2mol·L-1NaOH溶液等体积混合而得,则溶液M的pH ________7 (填“>”、“<”或“=”),溶液M中各微粒的浓度关系正确的是__________。
A.c(Na+)>c(A2-)>c(OH-)>c(H+)
B.c(HA-)+c(H2A)+c(H+)=c(OH-)
C.c(A2-)+c(HA-)+c(H2A)=1mol·L-1
D.c(A2-)+c(HA-)+c(OH-)=c(Na+)+c(H+)
(2) CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3
①Na2CO3俗称纯碱,因CO32-水解而使其水溶液呈碱性,试写出CO32-水解的离子方程式(忽略第二步水解)______________,其水解反应的平衡常数(即水解常数)的表达式为Kh=__________。
②已知25℃时,Kh=2×10-4mol/L,则当溶液中c(HCO3-):c(CO32-)=2:1时,试求溶液的pH=__________。
③0.1mol/L Na2CO3溶液中c(OH-)-c(H+)=__________(用含c(HCO3-)、c(H2CO3)的关系式表示)
④向 Na2CO3溶液中加入明矾会产生沉淀和气体,请写出相关的离子方程式__________________。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH===NaNO3+NaNO2+H2O。含0.2 mol NaOH 的水溶液与 0.2molNO2恰好完全反应得1L溶液A,溶液B为0.1mol·L-1的CH3COONa溶液,则两溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的顺序为__________。(已知HNO2的电离常数Ka=7.1×10-4mol·L-1,CH3COOH的电离常数Ka=1.7×10-5mol·L-1),可使溶液A和溶液B的pH相等的方法是____________。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(4)直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)
n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
①由上表判断NaHSO3溶液显____性,用化学平衡原理解释:______________________。
②当吸收液呈中性时,溶液中出离子浓度关系正确的是(选填字母)_________________。
A.c(Na+)=2c(SO32-)+c(HSO3-)
B.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
C.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)