题目内容
关于钠元素的单质及其化合物的叙述中,不正确的是( )
分析:A、金属钠物理性质:银白色金属、质软、熔点低、密度比水小;
B、金属钠的应用知识来回答;
C、根据钠长期暴露在空气中,发生的一系列变化:切开金属钠置于空气中,切口开始呈银白色→变暗→变白色固体→成液→结块→最后变成Na2CO3粉末;
D、过氧化钠不属于碱性氧化物,是淡黄色固体.
B、金属钠的应用知识来回答;
C、根据钠长期暴露在空气中,发生的一系列变化:切开金属钠置于空气中,切口开始呈银白色→变暗→变白色固体→成液→结块→最后变成Na2CO3粉末;
D、过氧化钠不属于碱性氧化物,是淡黄色固体.
解答:解:A、金属钠物理性质:银白色金属、质软、熔点低、密度比水小,故A正确;
B、金属钠的应用:高压钠灯发的黄光透雾能力强,常用作路灯,故B正确;
C、切开金属钠置于空气中,切口开始呈银白色(钠的真面目)→变暗(生成Na2O)→变白色固体(生成NaOH)→成液(NaOH潮解)→结块(吸收CO2成Na2CO3?10H2O)→最后变成Na2CO3粉(风化),有关反应如下:4Na+O2=2Na2O、Na2O+H2O=2NaOH、2NaOH+CO2=Na2CO3+H2O、Na2CO3+10H2O=Na2CO3?10H2O、Na2CO3?10H2O=Na2CO3+10H2O,故C正确;
D、过氧化钠与酸反应时,不仅有盐生成,还放出O2,不属于碱性氧化物,属于过氧化物,是淡黄色固体,故D错误.
故选D.
B、金属钠的应用:高压钠灯发的黄光透雾能力强,常用作路灯,故B正确;
C、切开金属钠置于空气中,切口开始呈银白色(钠的真面目)→变暗(生成Na2O)→变白色固体(生成NaOH)→成液(NaOH潮解)→结块(吸收CO2成Na2CO3?10H2O)→最后变成Na2CO3粉(风化),有关反应如下:4Na+O2=2Na2O、Na2O+H2O=2NaOH、2NaOH+CO2=Na2CO3+H2O、Na2CO3+10H2O=Na2CO3?10H2O、Na2CO3?10H2O=Na2CO3+10H2O,故C正确;
D、过氧化钠与酸反应时,不仅有盐生成,还放出O2,不属于碱性氧化物,属于过氧化物,是淡黄色固体,故D错误.
故选D.
点评:本题考查学生金属钠以及过氧化钠的化学性质知识,可以根据所学知识来回答,难度不大.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案
相关题目
短周期元素X、Y、Z、W在周期表中的位置关系如右图所示,已知在同周期元素的常见简单离子中,W的简单离子半径最小,X、Y、Z、W的单质及其化合物在日常生活中用途极其广泛。
| X | Y | Z |
W |
|
|
|
(1)X元素在元素周期表中的位置___? __________。
(2)X、Y、Z元素的氢化物均有两种或两种以上,其中一定条件下,液态YH3与液态H2Z可以发生类似方式电离,则液态YH3中阴离子的电子式为_______________。
(3)超细WY粉末被应用于大规模集成电路领域。其制作原理为W2Z3、Y2、X在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1∶1;其反应的化学方程式为????????????????????????????? _。
(4)以W为材料制成的容器在空气中具有自我保护作用,这种容器____(填“能”或“不能”)用来腌制咸菜,原因是_________________________________________。
(5)某汽车尾气分析仪以燃料电池为工作原理测定XZ的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中Z2-可以在固体介质NASICON中自由移动。则负极的反应式___________。

关于该电池的下列说法,正确的是______
A.工作时电极b作正极,Z2- 通过固体介质NASICON由电极b流向电极a
B.工作时电流由电极a通过传感器流向电极b
C.传感器中通过的电流越大,尾气中XZ的含量越高
(6)由元素X与元素Z组成的某种阴离子具有还原性,能被酸性KMnO4氧化,请填写相应的离子,并给予配平: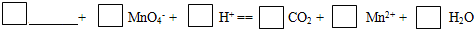 。
。
下列关于硅及其化合物的说法正确的是
A.SiO2是酸性氧化物,硅酸的酸酐, 但是它不与水、烧碱反应 但是它不与水、烧碱反应 |
| B.硅元素是自然界构成岩石、矿物的主要成分,其单质是半导体,不与任何酸碱反应 |
| C.硅酸钠溶液加入盐酸产生白色浑浊,再加入足量的烧碱,溶液恢复澄清 |
D.硅酸钠溶液中 缓慢通入足量二氧化碳,先产生浑浊后恢复澄清 缓慢通入足量二氧化碳,先产生浑浊后恢复澄清 |