题目内容
【题目】废旧显示屏玻璃中含有SiO2、Fe2O3、CeO2、FeO等物质。某课题小组以此玻璃粉末为原料,制得Ce(OH)4和硫酸铁铵矾[化学式为xFe2(SO4)3·y(NH4)2SO4·zH2O],流程设计如下:
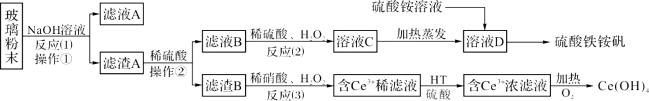
已知:Ⅰ、酸性条件下,铈在水溶液中有Ce3+、Ce4+两种主要存在形式,Ce4+有较强氧化性;
Ⅱ、CeO2不溶于稀硫酸,也不溶于氢氧化钠溶液。
回答以下问题:
(1)操作①的名称是_____________;该操作所用的玻璃仪器有:烧杯、_________、_________。
(2)反应(2)中过氧化氢的作用是:_________________________。
(3)反应(3)的离子方程式是:_____________________。
(4)已知有机物HT能将Ce3+从水溶液中萃取出来,该过程可表示为:
2Ce3+(水层)+6HT(有机层)![]() 2CeT3(有机层)+6H+(水层)
2CeT3(有机层)+6H+(水层)
从平衡角度解释:向CeT3(有机层)加入硫酸获得较纯的含Ce3+的水溶液的原因是_________________。
(5)硫酸铁铵矾广泛用于水的净化处理,其净水原理用离子方程式表示为:_________________。
(6)相同物质的量浓度的以下四种溶液中,铵根离子浓度由大到小的顺序是:_________________。
a.xFe2(SO4)3·y(NH4)2SO4·zH2O
b.(NH4)2SO4
c.(NH4)2CO3
d.NH3·H2O
(7)为测定某硫酸铁铵矾样品的组成,现称取14.00 g该样品,将其溶于水配制成100 mL溶液;再将溶液分成两等份,向其中一份加入足量氢氧化钠溶液,过滤、洗涤沉淀、再烘干灼烧至恒重,得到1.60 g固体;向另一份溶液中加入0.5 mol/L硝酸钡溶液100 mL,恰好完全反应。则该硫酸铁铵矾的化学式为____________________。
【答案】(1)过滤;玻璃棒;漏斗;(2)将Fe2+氧化为Fe3+;
(3)2CeO2+6H++H2O2=2Ce3++4H2O+O2↑;
(4)混合液中加入H2SO4使c(H+)增大,平衡向形成Ce3+水溶液方向移动;
(5)Fe3++3H2O![]() Fe(OH)3(胶体)+3H+;
Fe(OH)3(胶体)+3H+;
(6)a>b>c>d;(7)Fe2(SO4)3·2(NH4)2SO4·2H2O。
【解析】
试题分析:(1)根据操作①,得到滤液和滤渣,此操作是过滤,过滤时需要的玻璃仪器有烧杯、玻璃棒、漏斗;(2)硫酸铁铵矾中铁显+3价,以及废旧显示屛含有FeO,因此过氧化氢的作用是把Fe2+氧化成Fe3+;(3)滤渣B中CeO4中Ce显+4价,反应(3)得到Ce3+,因此在反应中+4价Ce作氧化剂,过氧化氢作还原剂,转化成氧气,根据化合价升降法进行配平,因此离子反应方程式为:2CeO2+6H++H2O2=2Ce3++4H2O+O2↑;(4)此反应是可逆反应,加入硫酸,增加c(H+)平衡向逆反应方向移动;(6)Fe3+发生水解成氢氧化铁胶体,即Fe3++3H2OFe(OH)3(胶体)+3H+,利用胶体的表面积大,吸附水中悬浮固体小颗粒,达到净水的目的;(6)NH4+属于弱碱根离子,发生水解,但水解的程度微弱,NH3·H2O属于弱碱,部分发生电离,因此铵盐中NH4+的浓度大于NH3·H2O中c(NH4+),即d中c(NH4+)最小,碳酸铵属于弱酸弱碱盐,发生双水解反应,但不彻底,因此三种铵盐中c(NH4+)最小,Fe3+得OH-能力大于NH4+得OH-,Fe3+的水解对NH4+水解起抑制作用,因此硫酸铁铵矾中c(NH4+)最大,因此c(NH4+)大小顺序是:abcd;(7)加入足量的氢氧化钠溶液,生成沉淀的反应是:Fe3++3OH-=Fe(OH)3↓,灼烧烘干,得到固体是Fe2O3,因此n(Fe2O3)=1.6/160mol=0.01mol,样品中铁的物质的量为0.01×2×2mol=0.04mol,加入硝酸钡发生的反应是:Ba2++SO42-=BaSO4↓,n(SO42-)=100×10-3×0.5mol=0.05mol,样品中n(SO42-)=0.05×2mol=0.1mol,根据电荷守恒,n(NH4+)=2n(SO42-)-3n(Fe3+)=(2×0.1-3×0.04)mol=0.08mol, 结晶水的质量为=(14-0.04×56-0.1×96-0.08×18)g= 0.72g,n(H2O)=0.72/18mol=0.04mol,因此x:y:z=0.02:0.04:0.04=1:2:2,化学式为: Fe2(SO4)3·2(NH4)2SO4·2H2O。