题目内容
【题目】现有A、B、C、D四种短周期主族元素,其原子序数依次增大。已知A、C位于同一主族,C是短周期中原子半径最大的。B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍。请回答下列问题:
(1)元素D在周期表中的位置是___________。C2B2所含的化学键类型有_____________;
(2)请写出C2B2与A2B反应的离子方程式,用单线桥法表示电子转移的方向和数目 ____________________________________________________。
(3)元素B、C形成的简单离子中半径较大的是___________(写电子式)。
(4)用电子式表示化合物C2D的形成过程:______________________________________。
(5)化合物M和N,都由A、B、C、D四种元素组成,它们在溶液中相互反应的离子方程式_____。
【答案】 第三周期ⅥA族 离子键、共价键(或非极性共价键) 
![]()
![]() H++HSO3-===H2O + SO2↑
H++HSO3-===H2O + SO2↑
【解析】短周期的四种元素A、B、C、D,它们的原子序数依次增大,C是短周期中原子半径最大的,则C为钠元素,A、C位于同一主族, B、D的最外层电子数相等,即为同主族元素,且B、D的原子序数之和为A、C原子序数之和的两倍,则A为H元素,因此B为氧元素,D为硫元素。
(1)D为硫元素,在周期表中位于第三周期ⅥA族。过氧化钠属于离子化合物,所含的化学键有离子键、共价键,故答案为:第三周期ⅥA族;离子键、共价键;
(2)过氧化钠与水反应生成氢氧化钠和氧气,反应的离子方程式为2Na2O2+2H2O===4Na++4OH-+O2↑,用单线桥法表示电子转移的方向和数目为 ,故答案为:
,故答案为: ;
;
(3)一般而言,离子的电子层数越多,离子半径越大,电子层数相同时,核电荷数越大,离子半径越小,元素B、C形成的简单离子中半径较大的是氧离子![]() ,电子式为,故答案为:
,电子式为,故答案为:![]() ;
;
(4)用电子式表示氧化钠的形成过程为![]() ,故答案为:
,故答案为:![]() ;
;
(5)由A、B、C、D四种元素组成的化合物M和N,分别为亚硫酸氢钠和硫酸氢钠,它们在溶液中相互反应的离子方程式为H++HSO3-===H2O + SO2↑,故答案为:H++HSO3-===H2O + SO2↑。

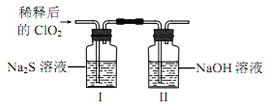
【题目】二氧化氯(ClO2)是极易溶于水且不与水发生化学反应的黄绿色气体,沸点为11℃,可用于处理含硫废水。某小组在实验室中探究ClO2与Na2S的反应。回答下列问题:
(l)ClO2的制备:(已知:SO2+2NaClO3+H2SO4=2ClO2↑+2NaHSO4)

①装置A中反应的化学方程式为_______________。
②欲收集干燥的ClO2,选择上图中的装置,其连接顺序为 a→_________(按气流方向,用小写字母表示)
③装置D的作用是_________。
(2)ClO2与 Na2S 的反应
将上述收集到的ClO2用 N2稀释以增强其稳定性,并将适量的稀释后的ClO2通入上图所示装置中充分反应,得到无色澄清溶液。一段时间后,通过下列实验探究 I 中反应的产物。
操作步骤 | 实验现象 | 结论 |
取少量Ⅰ中溶液于试管甲中, 加入Ba(OH)2溶液,振荡 | ①_________ | 有硫酸根离子生成 |
另取少量Ⅰ中溶液于试管乙中, 滴加品红溶液和盐酸 | 品红溶液不翅色 | ② 无_____生成 |
若在试管甲中继续加Ba(OH)2溶液至 过量,静置,取上层清液于试管丙③______ | 有白色沉淀生成 | 有Cl-生成 |
④ClO2与Na2S反应的离子方程式为__________。用于处理含硫废水时,ClO2相对于Cl2的优点是____________(任写2条)。




