��Ŀ����
����Ŀ��A��B��C��D����ѧ��ѧ�г����ĵ��ʣ�DΪ�ؿ��к������Ľ������ס��ҡ���Ϊ��������м�Ϊ�д��Եĺ�ɫ���壬���ڳ��³�ѹ��Ϊ��ɫҺ�壮�����ʵ�ת����ϵ���£�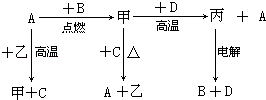
��1�����D��Ԫ�������ڱ��е�λ���� ��
��2������һ�ַ�Ӧ����������ת�������漰����ȫ����Ӧ���÷�Ӧ������ ��
��3����������ⷴӦ�У������ļ���Ӧʽ�� ��
��4����D��Ӧ�Ļ�ѧ����ʽ�� ��
��5��D��ij���γ����ھ�ˮ�������ӷ���ʽ��ʾ�侻ˮԭ�� ��
���𰸡�
��1���������ڵڢ�A��
��2��������ԭ��Ӧ
��3��2O2����4e��=O2��
��4��3Fe3O4+8Al ![]() 9Fe+4Al2O3
9Fe+4Al2O3
��5��Al3++3H2O?Al��OH��3+3H+
���������⣺DΪ�ؿ��к������Ľ�����ӦΪAl����Ϊ�д��Եĺ�ɫ���壬ӦΪFe3O4 �� ���ڳ��³�ѹ��Ϊ��ɫҺ�壬ӦΪH2O����ת����ϵ��+D����+A��֪����ΪAl2O3 �� AΪFe�������ɵõ�������������BΪO2 �� ����ˮ�����ڸ����·�Ӧ����Fe3O4��H2 �� ��CΪH2 �� ��1�������Ϸ�����֪DΪAl��λ�����ڱ��������ڵڢ�A�壬���Դ��ǣ��������ڵڢ�A�壻��2�����з�Ӧ���ɵ��ʲμӣ�һ��Ϊ������ԭ��Ӧ�����Դ��ǣ�������ԭ��Ӧ����3���������������������������Ӧ��������������������ԭ��Ӧ�������������缫����ʽΪ2O2����4e��=O2�������Դ��ǣ�2O2����4e��=O2������4����D��ӦΪ���ȷ�Ӧ������ʽΪ3Fe3O4+8Al ![]() 9Fe+4Al2O3 �� ���Դ��ǣ�3Fe3O4+8Al
9Fe+4Al2O3 �� ���Դ��ǣ�3Fe3O4+8Al ![]() 9Fe+4Al2O3����5�����������ھ�ˮ����Ҫ��������������ˮ������ɾ��������Ե������������壬���ӷ���ʽΪAl3++3H2OAl��OH��3+3H+ �� ���Դ��ǣ�Al3++3H2OAl��OH��3+3H+ ��
9Fe+4Al2O3����5�����������ھ�ˮ����Ҫ��������������ˮ������ɾ��������Ե������������壬���ӷ���ʽΪAl3++3H2OAl��OH��3+3H+ �� ���Դ��ǣ�Al3++3H2OAl��OH��3+3H+ ��

 ��У����ϵ�д�
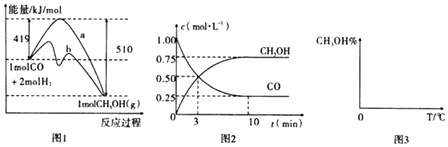
��У����ϵ�д�����Ŀ��ij�¶��£���2L�����ܱ������г���1.0mol A��1.0mol B����ӦA��g��+B��g��C��g������һ��ʱ���ﵽƽ�⣮��Ӧ�����вⶨ�IJ������ݼ��±�������˵����ȷ���ǣ� ��
t/s | 0 | 5 | 15 | 25 | 35 |
n��A��/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
A.��Ӧ��ǰ5s��ƽ������v��A��=0.17molL��1s��1
B.���������������䣬�����¶ȣ�ƽ��ʱc��A��=0.41molL��1 �� ��Ӧ�ġ�H��0
C.��ͬ�¶��£���ʼʱ�������г���2.0mol C���ﵽƽ��ʱ��C��ת���ʴ���80%
D.��ͬ�¶��£���ʼʱ�������г���0.20mol A��0.20mol B��1.0mol C����Ӧ�ﵽƽ��ǰv��������v���棩