题目内容
实验室需配制一种仅含五种离子(忽略水电离出的离子)的混合溶液,且在混合溶液中五种离子的物质的量浓度均为5 mol/L,下面四个选项中能达到此目的的是( )
| A.Na+、K+、SO42?、NO3?、Cl? |
| B.Fe2+、H+、Br?、NO3?、Cl? |
| C.Ca2+、K+、OH?、Cl?、NO3? |
| D.Al3+、Na+、Cl?、SO42?、NO3? |
D
解析试题分析:该题应注意两个方面的要求,其一是共存,其二是电荷守恒。A、电荷不守恒,错误;B、Fe2+被酸性条件下的NO3?氧化而不能共存,错误;C、Ca2+与OH?不能大量共存,错误;D、正确。
考点:考查离子大量共存有关问题。

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
下列离子方程式书写正确的是( )
A.将过量的二氧化碳通入氢氧化钠溶液: |
B.氯化铝溶液中加入过量浓氨水: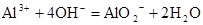 |
C.氯化铁溶液中加入铁粉: |
D.碳酸钙和盐酸反应: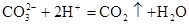 |
能正确表示下列反应的离子方程式是
| A.硫酸铝溶液中加入过量氨水:Al3++3OH—=Al(OH)3↓‘ |
| B.碳酸钠溶液中加入澄清石灰水:Ca(OH)2+CO32—=CaCO3+2OH— |
| C.冷的氢氧化钠溶液中通入氯气:Cl2+2OH—=ClO-+Cl—+H2O |
| D.稀硫酸中加人铁粉:2 Fe+6H+=2Fe3++3H2↑ |
下列反应的离子方程式正确的是( )
| A.少量二氧化碳通入水玻璃中: CO2 + SiO32― + H2O = CO32―+ H2SiO3↓ |
| B.钠投入水中:Na+ H2O = Na++OH-+ H2↑ |
| C.AlCl3溶液中加入过量氨水: Al3++4OH-= AlO2-+2H2O |
D.氯气通入水中:Cl2+H2O 2H++Cl-+ClO- 2H++Cl-+ClO- |
某溶液中有①NH4+、②Mg2+、③Fe2+、④Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是
| A.①② | B.①③ | C.②③ | D.③④ |
下列离子组一定能大量共存的是
| A.甲基橙呈红色的溶液中:I-、Cl-、NO3-、Na+ |
| B.石蕊呈蓝色的溶液中:Na+、AlO2-、NO3-、HCO3- |
| C.含大量Al3+的溶液中:K+、Na+、NO3-、ClO- |
| D.含大量OH一的溶液中:CO32-、Cl-、F-、K+ |
下列是某同学对相应反应的离子方程式所作的评价,其中评价合理的是
| 编号 | 化学反应 | 离子方程式 | 评价 |
| A | 碳酸钙与醋酸反应 | CO32-+2CH3COOH =2CH3COO-+H2O+CO2↑ | 错误,碳酸钙是弱电解质,不拆写 |
| B | Ba(HCO3)2溶液中通入过量NaOH溶液 | Ba2++HCO3-+OH-=BaCO3↓+H2O | 正确 |
| C | 碳酸氢钠的水解 | HCO3-+H2O OH-+H2CO3 OH-+H2CO3 | 正确 |
| D | 等物质的量的FeBr2和Cl2反应 | 2Fe2++2Cl2=2Fe3++4Cl- | 正确 |
下列离子方程式书写正确的是
| A.金属钠和水反应:Na+H2O=Na++OH-+H2↑ |
| B.澄清石灰水中加入通入少量CO2 :Ca2++2OH-+ CO2 = CaCO3↓+H2O |
| C.过氧化钠与冷水反应:2O22-+ 2H2O = 4OH-+ O2↑ |
| D.H2SO4与Ba(OH)2混合:SO42-+Ba2++H++OH-=BaSO4↓+H2O |
下列图示与对应的叙述相符的是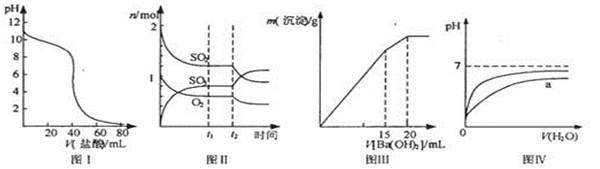
| A.图I表示盐酸滴加到0.1mol/L某碱溶液得到的滴定曲线,用已知浓度盐酸滴定未知浓度该碱时最好选取酚酞作指示剂 |
B.图II表示一定条件下进行的反应2SO2 +O2 2SO3各成分的物质的量变化,t2时刻改变的条件可能是缩小容器体积 2SO3各成分的物质的量变化,t2时刻改变的条件可能是缩小容器体积 |
| C.图III表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20mL Ba(OH)2溶液时铝离子恰好沉淀完全 |
| D.图IV表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应 的是盐酸 |