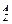题目内容
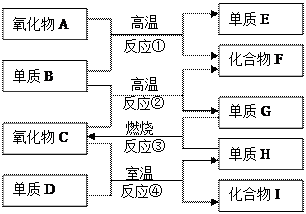
如上图,已知:
①单质E可作为半导体材料;
②化合物F是不能生成盐的氧化物;
③化合物I能溶于水呈酸性,它能够跟氧化物A起反应。
据此,请填空:
(1)化合物F是 。
(2)化合物I是 。
(3)反应③的化学方程式 。
(4)反应④的化学方程式 。
(1)CO;(2)HF;(3)2H2+O2=2H2O;(4)2F2+2H2O=4HF+O2。
本题主要考查元素化合物的性质,是一道常规的框图推断题。要求学生能全面系统地掌握元素及化合物性质的基础上,善于抓住某些元素的特殊性质为解题的突破口和切入点。由题中所叙述的条件,单质E为半导体材料,化合物F为不成盐氧化物,结合框图中的反应①可推知E和F分别为Si和CO。反应①为:SiO2+2C==Si+2CO。氧化物A是SiO2,它除了跟氢氟酸反应以外不跟任何酸反应,由此可判断化合物I为HF。
 由“氧化物C+单质D HF+单质H”可推知该反应为:2F2+2H2O=4HF+O2。至此即可突破全题。
由“氧化物C+单质D HF+单质H”可推知该反应为:2F2+2H2O=4HF+O2。至此即可突破全题。
 由“氧化物C+单质D HF+单质H”可推知该反应为:2F2+2H2O=4HF+O2。至此即可突破全题。
由“氧化物C+单质D HF+单质H”可推知该反应为:2F2+2H2O=4HF+O2。至此即可突破全题。
练习册系列答案
相关题目
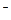 结构,且含有非极性键)的电子式: 。
结构,且含有非极性键)的电子式: 。