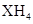题目内容
下表是元素周期表中一部分,表中所列的字母分别代表某一化学元素。根据表中所列元素回答下列问题。
(1)元素d是 (填“金属元素”或“非金属元素”);最活泼非金属元的元素符号是 ;最高价氧化物对应的水化物酸性最强的化合物是 ;
(2)地壳中含量最高的元素于周期表的位置是 ,其离子的结构示意图为 。
(3) 表中能形成两性氢氧化物的元素是 (用元素符号表示),写出该元素的单质与a的最高价氧化物的水化物的溶液反应的离子方程式: ;
(4) f、e、g、h中原子半径最小的是 (填元素符号);e、g、h的氢化物稳定性由大到小的顺序为 (填化学式)。
(5) a的最高价氧化物对应的水化物不能装在带磨口玻璃塞的试剂瓶,请用离子方程式说明其原因_________________________________________________________;
(6)工业上生产f单质的化学反应方程式为 。
| b | | | |||||||||||||||
| | | | | e | | g | h | | |||||||||
| a | | | c | f | | | i | j | |||||||||
| | | | | | | | | | | d | | | | | | | |
| | | | | | | | | | | | | | | | | | |
(2)地壳中含量最高的元素于周期表的位置是 ,其离子的结构示意图为 。
(3) 表中能形成两性氢氧化物的元素是 (用元素符号表示),写出该元素的单质与a的最高价氧化物的水化物的溶液反应的离子方程式: ;
(4) f、e、g、h中原子半径最小的是 (填元素符号);e、g、h的氢化物稳定性由大到小的顺序为 (填化学式)。
(5) a的最高价氧化物对应的水化物不能装在带磨口玻璃塞的试剂瓶,请用离子方程式说明其原因_________________________________________________________;
(6)工业上生产f单质的化学反应方程式为 。
(14分)(1)金属元素 F HC1O4 (各1分,共3分)
(2)第二周期VIA族 (各1分,共2分)
(各1分,共2分)
(3)Al (1分) 2NaOH +2Al+6H2O=2Na[Al(OH)4]+3H2↑(2分)
(4)F(1分) HF >H2O >CH4 (1分)
(5) SiO2+2OH-=SiO32-+H2O (2分)
(6) SiO2 + 2C 高温 Si + 2CO↑ (2分)
(2)第二周期VIA族
 (各1分,共2分)
(各1分,共2分)(3)Al (1分) 2NaOH +2Al+6H2O=2Na[Al(OH)4]+3H2↑(2分)
(4)F(1分) HF >H2O >CH4 (1分)
(5) SiO2+2OH-=SiO32-+H2O (2分)
(6) SiO2 + 2C 高温 Si + 2CO↑ (2分)
试题分析:(1)d所在的位置是过度金属所处的位置,故元素d是金属元素。周期表中最右上边的金属最活泼,即F元素。O、F没有最高正价,剩下的就属Cl元素的非金属最强,其最高价氧化物对应的水化物酸性最强,化学式为HC1O4。
(2) 地壳中含量最高的元素是O元素,在周期表的位置是第二周期VIA族。其离子的结构示意图为
 。
。(3) 能形成两性氢氧化物的元素是铝元素,即Al。a是钠,a最高价氧化物的水化物是NaOH,方程式为2NaOH +2Al+6H2O=2Na[Al(OH)4]+3H2↑。
(4)同周期,自左向右原子半径逐渐减小,非金属性逐渐增强,氢化物稳定性逐渐增强;同主族,在上向下原子半径逐渐增大。故f、e、g、h中原子半径最小的是h符号代表的元素,即F元素。e、g、h的氢化物稳定性由大到小的顺序为HF >H2O >CH4。
(5) a最高价氧化物的水化物是NaOH,玻璃中含有SiO2,能发生反应,方程式为SiO2+2OH-=SiO32-+H2O。
点评:本题考查学生元素元素周期表的结构和周期律的应用知识,可以根据所学知识进行回答,难度不大。

练习册系列答案
相关题目
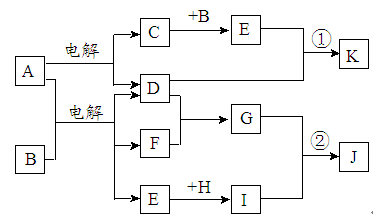
 ,这种元素的气态氢化物的化学式为( )
,这种元素的气态氢化物的化学式为( )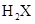 C
C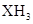 D.
D.