题目内容
下列叙述肯定正确的是( )
A.在离子晶体中不可能存在非极性键
B.在共价化合物的分子晶体中不可能存在离子键
C.在极性分子中不可能存在非极性键
D.在原子晶体中不可能存在极性共价键
B
【解析】本题主要考查晶体类型与化学键的关系。离子晶体中可能存在非极性键,如Na2O2、FeS2等;极性分子中可能存在非极性键,如H2O2;构成原子晶体的共价键不仅有金刚石、晶体硅等中的非极性键,也有SiO2、SiC等晶体中所含的极性键;只要晶体中含有离子键,一定属于离子晶体。故选B。

练习册系列答案
相关题目
已知X、Y、Z为同一短周期的三种元素,其原子的部分电离能(kJ·mol-1)如下表所示:
| X | Y | Z |
I1 | 496 | 738 | 578 |
I2 | 4562 | 1451 | 1817 |
I3 | 6912 | 7733 | 2745 |
I4 | 9543 | 10540 | 11575 |
(1)三种元素电负性大小关系为 。
(2)写出Y原子的电子排布式 ,Y的第一电离能大于Z的第一电离能的原因 。
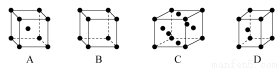
(3)X晶体采用下列 (填字母)堆积方式。
(4)含有元素X的盐的焰色反应为 色。许多金属盐都可以发生焰色反应,其原因是 。
(5)NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:
晶体 | NaCl | KCl | CaO |
晶格能/(kJ·mol-1) | 786 | 715 | 3401 |
4种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是 。