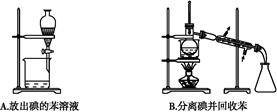
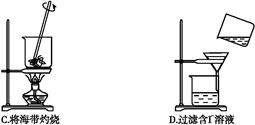
题目内容
实验室用MnO2和浓盐酸制取Cl2时,有14.6 g氯化氢被氧化,所得Cl2全部用NaOH溶液吸收,生成NaClO的物质的量是 ( )。
| A.0.1 mol | B.0.2 mol | C.0.3 mol | D.0.4 mol |
B
解析

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
下列叙述正确的是
| A.SO2能使品红溶液褪色是因为SO2具有氧化性,所以它也能使酸碱指示剂褪色 |
| B.硫化氢中硫显最低价态-2价,因此只具有还原性 |
| C.浓硫酸使木棒或棉花变黑,体现了浓硫酸的吸水性 |
| D.BaSO4可作“钡餐”进行X射线检查 |
现有等体积混合而成的四组气体:①NO2+NO;②NO2+O2;③HCl+N2;④NO+N2,将其分别通入体积相同的试管,并立即倒立于水槽中,试管内水面上升的高度分别为H1,H2,H3,H4,其中高度关系是
| A.H2>H3>H1>H4 | B.H3>H2>H1>H4 |
| C.H1=H2=H3=H4 | D.H1>H2>H3>H4 |
下列反应中,起到氮的固定作用的是 ( )
| A.NH3经催化氧化生成NO | B.N2和H2在一定条件下合成NH3 |
| C.NO与O2反应生成NO2 | D.由NH3制碳酸氢铵和尿素 |
化学家Seidel指出Si与NaOH溶液的反应,首先是Si与OH-反应,生成SiO44-,然后SiO44-迅速水解生成H4 SiO4,下列有关说法正确的是( )。
| A.原硅酸钠(Na4SiO4)能迅速水解,且水解后呈碱性,故Na4SiO4为弱电解质 |
| B.石英玻璃、普通玻璃、陶瓷及水泥均属于硅酸盐产品 |
| C.2HCl +Na2SiO3 = H2SiO3↓+2NaCl说明Cl 的非金属性大于Si |
| D.半导体工业所说的“从沙滩到家庭”是指:将二氧化硅制成晶体硅 |
氯气溶于水达到平衡后,若其他条件不变,只改变某一条件,下列叙述正确的是( )
| A.再通入少量氯气,c(H+)/c(ClO-)减小 |
| B.通入少量SO2,溶液漂白性增强 |
| C.加入少量固体NaOH,一定有c(Na+)=c(Cl-)+c(ClO-) |
| D.加入少量固体NaOH,溶液的pH会略微增大 |
在新制的氯水中加入少量的碳酸钠粉末,下列说法正确的是( )
| A.pH增大,HClO浓度增大 | B.pH减小,Cl-浓度增大 |
| C.pH增大,Cl-浓度减小 | D.pH减小,HClO浓度减小 |
下列说法正确的是( )
| A.海水中含量最高的元素是氯 |
| B.海水中含量最高的物质是氯化钠 |
| C.加碘食盐溶液遇淀粉溶液显蓝色 |
| D.加碘食盐中的碘是含碘元素的化合物 |