题目内容
【题目】下列离子方程式与所述事实相符且书写正确的是
A. 用铁作电极电解饱和氯化钠溶液:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
B. 碱性镉镍可充电电池的正极反应:NiO(OH)-e-+H2O==Ni(OH)2+OH-
C. AgOH沉淀溶于氨水:AgOH+2NH3·H2O==[Ag(NH3)2]++OH-+2H2O
D. 已知苯甲酸的酸性比碳酸强,向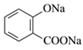 溶液中通入过量CO2:
溶液中通入过量CO2: +2CO2+2H2O—→
+2CO2+2H2O—→![]() +2HCO
+2HCO![]()
【答案】C
【解析】A、阳极铁溶解生成Fe2+,与阴极附近H+放电后生成的OH-结合生成Fe(OH)2沉淀;B、电池的正极是得电子的一极;C、Ag+与NH3分子形成配合离子[Ag(NH3)2]+,使AgOH沉淀溶解;D、只能是较强的酸与较弱酸的盐发生反应。
A、电解时,铁作阳极,失去电子而溶解,生成Fe2+,阴极上由于H+放电生成氢气,破坏了水的电离平衡,使溶液中OH-浓度增大,进而与Fe2+反应生成Fe(OH)2沉淀,所以A不正确;
B、电池的负极失去电子,电子经导线流向电池的正极,所以正极是得电子的一极,故B不正确;
C、Ag+具有空轨道,而NH3分子具有孤对电子,二者可以形成配合离子[Ag(NH3)2]+,使AgOH沉淀溶解,所以C正确;
D、苯甲酸的酸性比碳酸的强,碳酸的酸性比苯酚的强,向![]() 溶液中通入过量CO2,只能与酚钠—ONa反应,而不能与羧酸钠—COONa反应,所以D不正确。本题答案为C。
溶液中通入过量CO2,只能与酚钠—ONa反应,而不能与羧酸钠—COONa反应,所以D不正确。本题答案为C。

【题目】下列事实不能说明元素的金属性或非金属性相对强弱的是
序号 | 事实 | 推论 |
A | 与冷水反应,Na比Mg剧烈 | 金属性:Na > Mg |
B | Ca(OH)2的碱性强于Mg(OH)2 | 金属性:Ca > Mg |
C | SO2与NaHCO3溶液反应生成CO2 | 非金属性:S > C |
D | t℃时,Br2+H2 I2+H2 | 非金属性:Br > I |
A. A B. B C. C D. D