题目内容
1.0.3mol NH3中所含质子数与1.806×1023个H2O分子中所含质子数相等.2.2g D218O中所含中子数为7.224×1023,1.5g CH3+中电子数为4.816×1023,15.6g Na2O2中的阴离子数目为1.204×1023.分析 NH3、H2O分子均含有10个质子,二者含有质子数相等,则二者物质的量相等,再根据N=nNA计算水分子数目
;
根据n=$\frac{m}{M}$计算2.2g D218O的物质的量,每个D218O分子含有中子数为2×(2-1)+(18-8)=12,含有中子数为D218O分子的12倍;
根据n=$\frac{m}{M}$计算1.5g CH3+的物质的量,每个1.5g CH3+含有电子数8,电子物质的量为CH3+的8倍,再根据N=nNA计算电子数目;
根据n=$\frac{m}{M}$计算15.6g Na2O2的物质的量,过氧化钠由钠离子与过氧根离子构成,阴离子物质的量等于过氧化钠的物质的量.
解答 解:NH3、H2O分子均含有10个质子,则与0.3mol NH3中所含质子数相等的水的物质的量为0.3mol,水分子数目为0.3mol×6.02×1023mol-1=1.806×1023;
2.2g D218O的物质的量为$\frac{2.2g}{22g/mol}$=0.1mol,每个D218O分子含有中子数为2×(2-1)+(18-8)=12,含有中子数为0.1mol×12×6.02×1023mol-1=7.224×1023,
1.5g CH3+的物质的量为$\frac{1.5g}{15g/mol}$=0.1mol,每个1.5g CH3+含有电子数8,含有电子数目为0.1mol×8×6.02×1023mol-1=4.816×1023;
15.6g Na2O2的物质的量为$\frac{15.6g}{78g/mol}$=0.2mol,过氧化钠由钠离子与过氧根离子构成,阴离子物质的量等于过氧化钠的物质的量,则含有阴离子数目为0.2mol×6.02×1023mol-1=1.204×1023,
故答案为:1.806×1023;7.224×1023;4.816×1023;1.204×1023.
点评 本题考查微粒数目有关计算,难度不大,注意根据组成进行计算,理解化学式的意义.

 应用题作业本系列答案
应用题作业本系列答案| A. | 泡沫灭火器中的反应原理 | |
| B. | 草木灰(主要成分K2CO3)作为农作物肥料不能与铵态氮肥混用 | |
| C. | 明矾和漂白粉常作为抗洪救灾物质 | |
| D. | CuSO4可使蛋白质变性 |
| A. | 31g•mol-1 | B. | 32g•mol-1 | C. | 33g•mol-1 | D. | 17g•mol-1 |
| A. |  | B. | 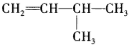 | ||
| C. |  | D. | 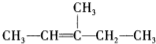 |
 ,写出该的单体的结构简式:CH2=CH2、CH2=CH-CN、C6H5-CH=CH2
,写出该的单体的结构简式:CH2=CH2、CH2=CH-CN、C6H5-CH=CH2 .
.