题目内容
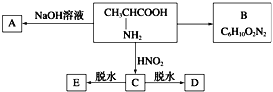
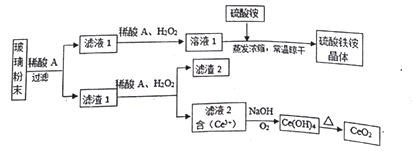
【题目】二氧化铈(CeO2是一种重要的稀土氧化物,平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、 Fe2O3、CeO2、FeO等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体。
已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液
(1)稀酸A的分子式是_____________________。
(2)滤液1中加入H2O2溶液的目的是____________________。滤渣1中加入稀酸A和H2O2发生反应的离子方程是为______________________。
(3)某同学设计实验证明滤液1中含有Fe2+,他所用的试剂的化学式为______________。
(4)己知溶液中的Fe2+可以和难溶于水的FeO(OH)反应生成Fe3O4,请书写该反应的离子方程式__________。
(5)由滤液2生成Ce(OH)4的离子方程式_____________________。
(6)硫酸铁铵晶体[Fe2(SO4)3·2(NH4)2SO4·3H2O]广泛用于水的净化处理,请用离子方程式解释其作用原理:_____________________ 。
【答案】 H2SO4 使 Fe2+氧化为 Fe3+ 2CeO2 + H2O2+ 6H+=2Ce3++O2+4 H2O 铁氰化钾溶液(或高锰酸钾溶液) Fe2++2FeO(OH)=Fe3O4+2H+ 4Ce3++O2+12OH-+2H2O=4Ce(OH)4↓ Fe3++3H2O![]() Fe(OH)3+3H+
Fe(OH)3+3H+
【解析】反应过程为:废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)中加入稀硫酸,FeO转化为FeSO4、Fe2O3转化Fe2(SO4)3存在于滤液1中,滤渣1为CeO2和SiO2;滤液1中加入稀硫酸和双氧水,FeSO4被氧化为Fe2(SO4)3,溶液1为Fe2(SO4)3溶液,加入硫酸铵混合蒸发浓缩、常温晾干后得到硫酸铁铵晶体;滤渣1中加入稀硫酸和H2O2,CeO2转化为Ce3+存在于滤液2中,反应为2CeO2 +H2O2+6H+=2Ce3++O2↑+4H2O,滤渣2为SiO2;滤液2加入碱并通入氧气将Ce从+3氧化为+4后Ce3+转化为沉淀Ce(OH)4,反应为:4Ce3++O2+12OH-+2H2O=4Ce(OH)4↓,加热分解Ce(OH)4得到产品CeO2;则
(1)已知:CeO2不溶于稀硫酸,废玻璃粉末中也不SiO2溶于酸,加入稀硫酸可将CeO2和SiO2与Fe2O3、FeO分离,因此稀酸A的分子式是H2SO4;(2)根据以上分析可知滤液1中加入H2O2溶液的目的是使Fe2+氧化为Fe3+。滤渣1中加入稀酸A和H2O2发生反应的离子方程是为2CeO2 +H2O2+6H+=2Ce3++O2↑+4H2O;(3)亚铁离子有还原性能使酸性高锰酸钾褪色,也与铁氰化钾生成蓝色沉淀,故证明滤液1中含有Fe2+的试剂为铁氰化钾溶液(或高锰酸钾溶液);(4)溶液中的Fe2+可以和难溶于水的FeO(OH)反应生成Fe3O4,根据原子守恒可知该反应的离子方程式为Fe2++2FeO(OH)=Fe3O4+2H+;(5)滤液2为含有Ce3+的溶液,加入碱并通入氧气将Ce从+3氧化为+4后Ce3+转化为沉淀Ce(OH)4,反应的离子方程式为:4Ce3++O2+12OH-+2H2O=4Ce(OH)4↓;(6)硫酸铁铵晶体溶于水后,由于存在水解反应Fe3++3H2O![]() Fe(OH)3+3H+,生成的氢氧化铁胶体具有吸附性,因此可以作为净水剂。
Fe(OH)3+3H+,生成的氢氧化铁胶体具有吸附性,因此可以作为净水剂。

 全优点练单元计划系列答案
全优点练单元计划系列答案【题目】氢气是一种理想的绿色能源。
(1)在101KP下,1g氢气完全燃烧生成液态水放出142.9kJ的热量,请回答下列问题:
①氢气的燃烧热为______________;
②该反应的热化学方程式为________________________________;
(2)氢能的存储是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:
Mg(s)+H2(g)===MgH2(s) ΔH1=-74.5kJ·mol-1;
Mg2Ni(s)+2H2(g)===Mg2NiH4(s) ΔH2;
Mg2Ni(s)+2MgH2(s)===2Mg(s)+Mg2NiH4(s) ΔH3=+84.6kJ·mol-1。
则ΔH2=____________kJ·mol-1;
某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
(3)倒入NaOH溶液的正确操作是_______________(从下列选出)。
A.沿玻璃棒缓慢倒入 B.一次迅速倒入 C.分三次少量倒入
(4)使硫酸与NaOH溶液混合均匀的正确操作是_________(从下列选出)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒搅拌棒轻轻地搅动
(5)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | |||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ______ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热△H=______________(取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是:___________。(任意写出一点)
【题目】下表为元素周期表的一部分,请参照元素①-⑩在表中的位置,用化学用语回答下列问题:
IA | IIA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 | |
1 | ① | |||||||
2 | ⑩ | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)④、⑤、⑥的原子半径由大到小的顺序为_______________(填元素符号)。
(2)根据对角线规则可知⑩与⑥有相似的性质,请写出⑩的最高价氧化物的水化物与⑤的最高价氧化物的水化物反应的化学方程式为:________________________。
(3)①、④、⑤、⑨四种元素中,某些元素间可形成既含离子键又含极性共价键的又具有强氧化性的化合物,写出其中—种化合物的电子式:____________。用电子式表示由①、③两种元素组成的既含极性共价键又含非极性共价键的化合物的形成过程:_____________。
(4)下列说法正确的是___________。
A.H2O与D2O互为同素异形体
B.所有物质中都存在化学键
C.共价化合物溶于水时,分子内共价键可能被破坏
D.元素的气态氢化物越稳定,非金属性越强,其水溶液的酸性越强,还原性越弱
(5)氢气是一种理想的绿色能源。
ⅰ.在101kPa下,1 g氢气完全燃烧生成液态水放出142.9kJ的热量,请回答下列问题:
则用来表示氢气的燃烧热的热化学方程式为________________。
ⅱ.氢能的存储是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:
Mg(s)+H2(g)=MgH2(s) △H1=-74.5kJ·mol-1
Mg2Ni(s)+2H2(g)=Mg2NiH4(s) △H2
Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s) △H3=+84.6kJ·mol-1。
则△H2=________kJ·mol-1