题目内容
铜及其化合物在工农业生产及日常生活中应用非常广泛。
⑴由辉铜矿制取铜的反应过程为:
2Cu2S(s) + 3O2 (g) = 2Cu2O(s) + 2SO2(g) △H=-768.2kJ·mol- 1,
1,
2Cu2O(s) + Cu2S(s) = 6Cu(s) + SO2(g) △H=+116.0kJ·mol-1,
①写出Cu2S与O2生成 Cu(s) 和SO2的热化学方程式: 。
②获得的粗铜需电解精炼,精炼时粗铜作 极(选填:“阳”或“阴”)。
⑵氢化亚铜是一种红色固体,可由CuSO4溶液和H3PO2反应制备。该反应的化学方程式为 。该反应每转移3mol电子,生成CuH的物质的量为 。
⑶氯化铜溶液中含铜粒子的分布分数与c(Cl-) 的关系如图所示。①当c(Cl-)=9mol·L-1时,溶液中主要的3种含铜微粒浓度大小关系为 。
②在c(Cl-)=1mol·L-1的氯化铜溶液中,滴入AgNO3溶液,含铜微粒间转化的离子方程式为 (任写一个)。
 阅读快车系列答案
阅读快车系列答案合成氨工业涉及固体燃料的气化,需要研究CO2与CO之间的转化。为了弄清其规律,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g) 2CO(g) ∆H,测得压强、温度对CO、CO2的平衡组成的影响如图所示:
2CO(g) ∆H,测得压强、温度对CO、CO2的平衡组成的影响如图所示:
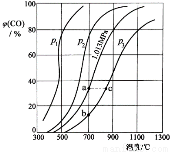
回答下列问题:
(1)p1、p2、p3的大小关系是______________,欲提高C与CO2反应中CO2的平衡转化率,应采取的措施为 。图中a、b、c三点对应的平衡常数大小关系是____________。
(2)900 ℃、1.013 MPa时,1 mol CO2与足量碳反应达平衡后容器的体积为V,CO2的转化率为_________,该反应的平衡常数K= 。
(3)将(2)中平衡体系温度降至640 ℃,压强降至0.1013 MPa,重新达到平衡后CO2的体积分数为50%。条件改变时,正反应和逆反应速率如何变化?_______,二者之间有何关系?____________________。
(4)一定条件下,在CO2与足量碳反应所得平衡体系中加入H2和适当催化剂,有下列反应发生:CO(g)+3H2(g) CH4(g)+H2O(g) ∆H1=-206.2 kJ/mol
CH4(g)+H2O(g) ∆H1=-206.2 kJ/mol
CO(g)+H2O(g) CO2(g)+H2(g) ∆H2=-41.2 kJ/mol
CO2(g)+H2(g) ∆H2=-41.2 kJ/mol
① 则二氧化碳与氢气反应转化为甲烷和水蒸气的热化学方程式是_________________。
② 已知298 K时相关化学键键能数据为:
化学键 | H—H | O—H | C—H |
|
E/(kJ·mol-1) | 436 | 465 | 413 | 1076 |
则根据键能计算,∆H1= ,它与上述实测值差异较大的原因可能是 。
下列关于有机物因果关系的叙述完全正确的一组是
选项 | 结 论 | 原 因 |
A | 乙烯和苯都能使溴水褪色 | 苯和乙烯分子都含有碳碳双键 |
B | 乙酸乙酯和乙烯一定条件下都能与水反应 | 两者属于同一类型的反应 |
C | 乙酸和葡萄糖都能与新制的氢氧化铜反应 | 两者所含的官能团相同 |
D | 乙烯能使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色 | 两者褪色的本质不同 |


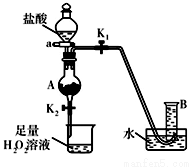
 则溶液颜色立即由棕黄色变为浅绿色
则溶液颜色立即由棕黄色变为浅绿色 程式C2H2(g)+5/2O2(g)═2CO2(g)+H2O(g)△H=﹣1256kJ/mol,下列说法正确的是( )
程式C2H2(g)+5/2O2(g)═2CO2(g)+H2O(g)△H=﹣1256kJ/mol,下列说法正确的是( )
 )的废水可以利用微生物电池除去,其原理如图所示,下列说法错误的是
)的废水可以利用微生物电池除去,其原理如图所示,下列说法错误的是
 C. 每有1 mol CH3COO-被氧化,电路中通过8 mol电子
C. 每有1 mol CH3COO-被氧化,电路中通过8 mol电子