题目内容
防止和治理环境污染是当前环保工作的重要研究内容之一。
(1)氮肥厂的氨氮废水经过初步处理后可得到低浓度氨氮废水,后续处理流程如下:
(1)氮肥厂的氨氮废水经过初步处理后可得到低浓度氨氮废水,后续处理流程如下:

过程I:在硝化细菌作用下,O2将NH4+氧化为NO3-;
过程II:加入甲醇,NO3-和甲醇反应转化CO2和N2。
请写出过程I步的离子方程式:_________________ 。
(2)Hg是水体污染的重金属元素之一。水溶液中二价汞的主要存在形态与Cl-、OH-的浓度关系如图所示[图中的物质或粒子只有Hg(OH)2为难溶物; pCl=-1gc(Cl-)]
过程II:加入甲醇,NO3-和甲醇反应转化CO2和N2。
请写出过程I步的离子方程式:_________________ 。
(2)Hg是水体污染的重金属元素之一。水溶液中二价汞的主要存在形态与Cl-、OH-的浓度关系如图所示[图中的物质或粒子只有Hg(OH)2为难溶物; pCl=-1gc(Cl-)]

①下列说法中正确的是_____________。
A.为了防止Hg2+水解,配制Hg(NO3)2溶液时应将Hg(NO3)2固体溶于浓硝酸后再稀释。 B.当c(Cl-) =10-1 mol·L-1时,汞元素一定全部以HgCl42-形式存在
C.HgCl2是一种弱电解质,其电离方程式是:HgCl2=HgCl+ + Cl-
D.当溶液pH保持在4,pCl由2改变至6时,可使HgCl2转化为Hg(OH)2
②HgCl2又称“升汞”,熔点549K,加热能升华,其晶体是_________(填晶体类型)。
(3)汽车尾气是城市空气污染的一个重要因素,常用以下反应净化汽车尾气:
2NO(g)+2CO(g) 2CO2(g)+N2(g) 在某温度T1℃下,2L密闭容器中充入NO 、CO各0.4mol,测得不同时间的NO和CO物质的量如下表:
2CO2(g)+N2(g) 在某温度T1℃下,2L密闭容器中充入NO 、CO各0.4mol,测得不同时间的NO和CO物质的量如下表:
A.为了防止Hg2+水解,配制Hg(NO3)2溶液时应将Hg(NO3)2固体溶于浓硝酸后再稀释。 B.当c(Cl-) =10-1 mol·L-1时,汞元素一定全部以HgCl42-形式存在
C.HgCl2是一种弱电解质,其电离方程式是:HgCl2=HgCl+ + Cl-
D.当溶液pH保持在4,pCl由2改变至6时,可使HgCl2转化为Hg(OH)2
②HgCl2又称“升汞”,熔点549K,加热能升华,其晶体是_________(填晶体类型)。
(3)汽车尾气是城市空气污染的一个重要因素,常用以下反应净化汽车尾气:
2NO(g)+2CO(g)
 2CO2(g)+N2(g) 在某温度T1℃下,2L密闭容器中充入NO 、CO各0.4mol,测得不同时间的NO和CO物质的量如下表:
2CO2(g)+N2(g) 在某温度T1℃下,2L密闭容器中充入NO 、CO各0.4mol,测得不同时间的NO和CO物质的量如下表: 
①根据上表的数据,在下图中画出CO2的物质的量与时间的关系曲线。
②上述反应达到平衡后,继续加入NO 、CO、CO2 各0.2mol和N2 __________ mol时,平衡不移动。
③在上述条件下该反应能够自发进行,如果把温度从T1℃升高到T2℃,平衡常数K将__________(填写“变大”、“变小”、“不变”)。
④一种CO分析仪的传感器可测定汽车尾气是否符合排放标准,该分析仪的工作原理类似燃料电池,其中的固体电解质是Y2O3-Na2O,O2ˉ可以在其中自由移动,负极的反应式为____________。
③在上述条件下该反应能够自发进行,如果把温度从T1℃升高到T2℃,平衡常数K将__________(填写“变大”、“变小”、“不变”)。
④一种CO分析仪的传感器可测定汽车尾气是否符合排放标准,该分析仪的工作原理类似燃料电池,其中的固体电解质是Y2O3-Na2O,O2ˉ可以在其中自由移动,负极的反应式为____________。
(1)2O2+NH4+==NO3-+2H+ +H2O
(2)①AD ; ②分子晶体
(3)①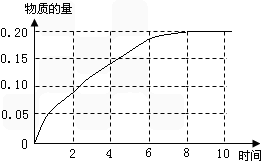 ;
;
② 0.1mol ; ③变小 ; ④ CO+ O2--2e-= CO2
(2)①AD ; ②分子晶体
(3)①
 ;
;② 0.1mol ; ③变小 ; ④ CO+ O2--2e-= CO2

练习册系列答案
相关题目


 二氧化硫和氮的氧化物是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一.
二氧化硫和氮的氧化物是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一. SO3(g);△H=-98 kJ·mol-1。开始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,该温度下平衡常数K= 。恒温下,若往容器中再加入4mol SO2(g),则重新达到平衡时SO2的总转化率 原平衡时SO2转化率(选填“>”、“<”或“=”)。
SO3(g);△H=-98 kJ·mol-1。开始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,该温度下平衡常数K= 。恒温下,若往容器中再加入4mol SO2(g),则重新达到平衡时SO2的总转化率 原平衡时SO2转化率(选填“>”、“<”或“=”)。