题目内容
Ⅰ、表中①~⑥为部分短周期元素的化合价及原子半径| 元素性质 | 元素编号 | |||||
| ① | ② | ③ | ④ | ⑤ | ⑥ | |
| 原子半径/nm | 0.102 | 0.110 | 0.074 | 0.075 | 0.071 | 0.099 |
| 最高化合价 | +6 | +5 | +5 | +7 | ||
| 最低化合价 | -2 | -3 | -2 | -3 | -1 | -1 |
Ⅲ、A与B两元素可形成化合物AB、AB2,二者均可用于制备化合物乙.
A、B、C均为上表中的元素,甲、乙为中学常见强酸.
请回答下列问题(1)写出B元素位于周期表中的位置______
(2)A元素气态氢化物的结构式为______,写出上述元素形成的最稳定的氢化物的电子式_______
(3)下列关于物质甲、乙的说法中正确的是______(填字母)
a.二者的浓溶液在常温时均可用铁制容器贮存
b.二者的浓溶液在敞口容器中放置,质量都会变化
c.二者的浓溶液在常温时均与铜反应
d.二者的稀溶液均具有强氧化性
(4)请写出工业上由CB2制备CB3的化学方程式______△2SO3
【答案】分析:Ⅰ、由表中短周期元素①~⑧的部分性质可知,①有-2、+6,③只有-2价,则①为S、③为O;②④均有+5、-3价,为第ⅤA族元素,结合原子半径可知,②为P,④为N;⑤最高价为+7,最低价为-1,故⑤为Cl;⑥只有-1价,则⑥为F元素;
A、B、C均为上表中的元素,甲、乙为中学常见强酸:
Ⅱ、B与C两元素可形成化合物CB2、CB3,为SO2、SO3,二者均可用于制备化合物甲,甲为硫酸、B为氧元素、C为硫元素;
Ⅲ、A与B两元素可形成化合物AB、AB2,则为NO、NO2,二者均可用于制备化合物乙,乙为硝酸、A为氮元素;
然后结合元素及其单质、化合物的性质来解答.
解答:解:Ⅰ、由表中短周期元素①~⑧的部分性质可知,①有-2、+6,③只有-2价,则①为S、③为O;②④均有+5、-3价,为第ⅤA族元素,结合原子半径可知,②为P,④为N;⑤最高价为+7,最低价为-1,故⑤为Cl;⑥只有-1价,则⑥为F元素;
A、B、C均为上表中的元素,甲、乙为中学常见强酸:
Ⅱ、B与C两元素可形成化合物CB2、CB3,为SO2、SO3,二者均可用于制备化合物甲,甲为硫酸、B为氧元素、C为硫元素;
Ⅲ、A与B两元素可形成化合物AB、AB2,则为NO、NO2,二者均可用于制备化合物乙,乙为硝酸、A为氮元素;
(1)B为氧元素,处于第二周期第ⅥA族,
故答案为:第二周期第ⅥA族;
(2)A元素气态氢化物为NH3,其结构式为 ;
;
上述元素中F元素非金属性最强,HF最稳定,其电子式为 ,
,
故答案为: ;
;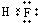 ;
;
(3)a.常温下,Fe与浓硫酸、浓硫酸发生钝化现象,二者的浓溶液在常温时均可用铁制容器贮存,故a正确;
b.浓硫酸具有吸水性,在敞口容器中放置,质量增大,浓硝酸具有挥发性,在敞口容器中放置,质量减小,故b正确;
c.浓硝酸在常温时与铜反应,浓硫酸需要加热与铜反应,故c错误;
d.二稀硝酸具有强氧化性,稀硫酸没有强氧化性,故d错误;
故答案为:ab;
(4)工业上由SO2制备SO3的化学方程式为:2SO2+O2 2SO3;
2SO3;
工业生产硝酸的过程中制备化合物NO的化学方程式为:4NH3+5O2 4NO+6H2O,
4NO+6H2O,
故答案为:2SO2+O2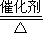 2SO3;4NH3+5O2
2SO3;4NH3+5O2 4NO+6H2O.
4NO+6H2O.
点评:本题考查元素周期表和元素周期律、常用化学用语、浓硫酸与浓硝酸性质、化学工业等,难度不大,利用表中元素的性质来推断元素是解答本题的关键.
A、B、C均为上表中的元素,甲、乙为中学常见强酸:
Ⅱ、B与C两元素可形成化合物CB2、CB3,为SO2、SO3,二者均可用于制备化合物甲,甲为硫酸、B为氧元素、C为硫元素;
Ⅲ、A与B两元素可形成化合物AB、AB2,则为NO、NO2,二者均可用于制备化合物乙,乙为硝酸、A为氮元素;
然后结合元素及其单质、化合物的性质来解答.
解答:解:Ⅰ、由表中短周期元素①~⑧的部分性质可知,①有-2、+6,③只有-2价,则①为S、③为O;②④均有+5、-3价,为第ⅤA族元素,结合原子半径可知,②为P,④为N;⑤最高价为+7,最低价为-1,故⑤为Cl;⑥只有-1价,则⑥为F元素;
A、B、C均为上表中的元素,甲、乙为中学常见强酸:
Ⅱ、B与C两元素可形成化合物CB2、CB3,为SO2、SO3,二者均可用于制备化合物甲,甲为硫酸、B为氧元素、C为硫元素;
Ⅲ、A与B两元素可形成化合物AB、AB2,则为NO、NO2,二者均可用于制备化合物乙,乙为硝酸、A为氮元素;
(1)B为氧元素,处于第二周期第ⅥA族,
故答案为:第二周期第ⅥA族;
(2)A元素气态氢化物为NH3,其结构式为
 ;
;上述元素中F元素非金属性最强,HF最稳定,其电子式为
 ,
,故答案为:
 ;
;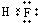 ;
;(3)a.常温下,Fe与浓硫酸、浓硫酸发生钝化现象,二者的浓溶液在常温时均可用铁制容器贮存,故a正确;
b.浓硫酸具有吸水性,在敞口容器中放置,质量增大,浓硝酸具有挥发性,在敞口容器中放置,质量减小,故b正确;
c.浓硝酸在常温时与铜反应,浓硫酸需要加热与铜反应,故c错误;
d.二稀硝酸具有强氧化性,稀硫酸没有强氧化性,故d错误;
故答案为:ab;
(4)工业上由SO2制备SO3的化学方程式为:2SO2+O2
 2SO3;
2SO3;工业生产硝酸的过程中制备化合物NO的化学方程式为:4NH3+5O2
 4NO+6H2O,
4NO+6H2O,故答案为:2SO2+O2
 2SO3;4NH3+5O2
2SO3;4NH3+5O2 4NO+6H2O.
4NO+6H2O.点评:本题考查元素周期表和元素周期律、常用化学用语、浓硫酸与浓硝酸性质、化学工业等,难度不大,利用表中元素的性质来推断元素是解答本题的关键.

练习册系列答案
 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案
相关题目
如表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下叙述正确的是( )
|
 乙酸乙酯的实验室和工业制法常采用如下反应:
乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OH
| ||
| △ |
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2?6C2H5OH;
②部分有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.5 | 78.5 | 117.9 | 77 |
(1)浓硫酸的作用是
(2)用如图所示装置来制备少量的乙酸乙酯,产率往往偏低,其原因可能为
(3)实验所得到的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,除去
(4)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂,且能重复使用.实验数据如下表所示(乙酸和乙醇以等物质的量混合).
| 同一反应时间 | 同一反应应温度 | ||||
| 反应温度/℃ | 转化率(%) | 选择性(%)* | 反应时间/h | 转化率(%) | 选择性(%)* |
| 40 | 77.8 | 100 | 2 | 80.2 | 100 |
| 60 | 92.3 | 100 | 3 | 87.8 | 100 |
| 80 | 92.6 | 100 | 4 | 92.3 | 100 |
| 120 | 94.5 | 98.7 | 6 | 93.0 | 100 |
| *选择性100%表示反应生成的产物全部是乙酸乙酯和水 | |||||
a.120℃,4hb.80℃,2hc.60℃,4hd.40℃,3h
②当反应温度达到120℃时,反应选抒性降低的原因可能为
工业尾气中氮氧化物通常采用氨催化吸收法,其原理是NH3与NOx在催化剂作用下反应生成无毒的物质.某校活动小组同学采用以下装置和步骤模拟工业上氮氧化物的处理过程.
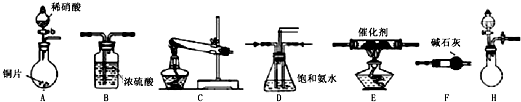
Ⅰ.探究制取NH3的方法
(1)在上述装置中,H能快速、简便制取NH3,装置中需要添加的反应试剂为 .
(2)为探究更好的实验效果,活动小组同学采用上述C装置来制取氨气,在控制实验条件相同的情况下,获得下表中实验数据.
分析表中数据,你认为哪种方案制取氨气的效果最好(填序号),从该方案选择的原料分析制气效果好的可能原因是 .
Ⅱ.模拟尾气处理
活动小组同学选用上述部分装置,按下列顺序连接成模拟尾气处理装置进行实验.
(1)请从上述装置中选择你认为合理的进行补充(所选装置不能重复).

(2)A中反应的离子方程式为 .
(3)D装置的作用有:使气体混合均匀、调节气流速度、 .
(4)D装置中的液体还可换成 (填序号).
a.H2O b.CCl4 c.浓H2SO4 d.CuSO4溶液
(5)该小组同学所设计的模拟尾气处理装置中还存在一处明显的缺陷是 .

Ⅰ.探究制取NH3的方法
(1)在上述装置中,H能快速、简便制取NH3,装置中需要添加的反应试剂为
(2)为探究更好的实验效果,活动小组同学采用上述C装置来制取氨气,在控制实验条件相同的情况下,获得下表中实验数据.
| 试剂组合序号 | 固体试剂 | NH3体积(mL) | |
| a | 6.0g Ca(OH)2(过量) | 5.4g NH4Cl | 1344 |
| b | 5.4g (NH4)2SO4 | 1364 | |
| c | 6.0g NaOH(过量) | 5.4g NH4Cl | 1568 |
| d | 5.4g (NH4)2SO4 | 1559 | |
| e | 6.0g CaO(过量) | 5.4g NH4Cl | 1753 |
| f | 5.4g (NH4)2SO4 | 1792 | |
Ⅱ.模拟尾气处理
活动小组同学选用上述部分装置,按下列顺序连接成模拟尾气处理装置进行实验.
(1)请从上述装置中选择你认为合理的进行补充(所选装置不能重复).

(2)A中反应的离子方程式为
(3)D装置的作用有:使气体混合均匀、调节气流速度、
(4)D装置中的液体还可换成
a.H2O b.CCl4 c.浓H2SO4 d.CuSO4溶液
(5)该小组同学所设计的模拟尾气处理装置中还存在一处明显的缺陷是

