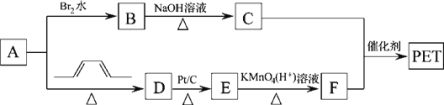
题目内容
【题目】下列说法正确的是![]()
A.核外电子排布相同的微粒化学性质相同
B.将FeCl3溶液加热蒸干,可以制备无水FeCl3
C.浓硝酸保存在棕色玻璃试剂瓶中
D.甲烷中混有乙烯,用高锰酸钾溶液除杂,可以得到纯净的甲烷
【答案】C
【解析】
A. 核外电子排布相同的微粒化学性质不一定相同,如S2-、Ar、K+,若互为同位素原子时化学性质相同,故A错误;
B. FeCl3溶液蒸发过程中会发生水解,生成氢氧化铁,氢氧化铁分解后生成三氧化二铁,所以将FeCl3溶液加热蒸干,无法制备无水FeCl3,故B错误;
C. 浓硝酸见光或受热易分解,浓硝酸保存在棕色玻璃试剂瓶中,故C正确;
D. 甲烷中混有乙烯,用高锰酸钾溶液除杂,会生成二氧化碳,引入新的杂质,得不到纯净的甲烷,故D错误;
故选C。

【题目】用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,试根据实验回答:
(1)将准确称取的4.3g烧碱样品配成250mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有___、___。
(2)取10.00mL待测液,用___滴定管量取。
(3)用0.2010mol/L标准盐酸滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视___,直到滴定到终点。
(4)根据下列数据,c(NaOH)=___,烧碱的纯度为___。
滴定次数 | 待测液体积 (mL) | 标准盐酸的体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 4.00 | 24.10 |
(5)以标准盐酸溶液滴定未知的氢氧化钠溶液为例,判断下列操作引起的误差(填偏大、偏小、无影响)
①读数:滴定前平视,滴定后俯视___。
②未用标准液润洗滴定管___。
③用待测液润洗锥形瓶___。
④不小心将标准液滴在锥形瓶外面___。
⑤滴定接近终点时,用少量蒸馏水冲洗锥形瓶内壁___。
【题目】![]() 分解速率受多种因素影响。实验测得
分解速率受多种因素影响。实验测得![]() 时不同条件下
时不同条件下![]() 浓度随时间的变化如图所示
浓度随时间的变化如图所示![]() 起始浓度均为
起始浓度均为![]() 。下列说法正确的是
。下列说法正确的是![]()
![]()
实验条件 |
|
|
|
① | 0 | 0 | |
② |
| 0 | |
③ |
| 3 | |
④ |
| 3 |
A.![]() 内,④条件下
内,④条件下![]() 的平均反应速率为
的平均反应速率为![]()
B.分析②③条件可知,![]() 浓度越大,
浓度越大,![]() 分解速率越慢
分解速率越慢
C.少量![]() 存在时,溶液碱性越强,
存在时,溶液碱性越强,![]() 分解速率越快
分解速率越快
D.分析①②条件可知,无![]() 时,碱性条件有利于双氧水的分解
时,碱性条件有利于双氧水的分解