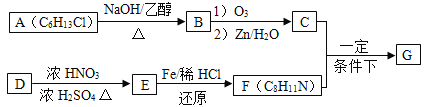
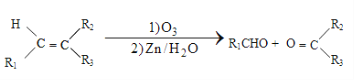题目内容
【题目】某铝合金中含有铝、镁、铜、硅,为了测定该合金中铝的含量,有人设计了如下实验:
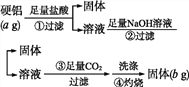
(1)写出上述第①②③步反应的离子方程式及第④步反应的化学方程式:
①___________,__________;
②____________,____________,
Al3++4OH-=Al+2H2O;
③________,AlO2-+CO2+2H2O![]() Al(OH)3↓+HCO3-;
Al(OH)3↓+HCO3-;
④_____________。
(2)该样品中铝的质量分数是_______。
(3)第②步中加入的NaOH溶液不足时,会使测定结果_____;第④步中的沉淀没有用蒸馏水洗涤时,会使测定结果_____;第④步对沉淀灼烧不充分时,会使测定结果_____。(填选项)
A.偏高 B.偏低 C.无影响
【答案】 Mg+2H+=Mg2++H2↑ 2Al+6H+=2Al3++3H2↑ H++OH-=H2O Mg2++2OH-=Mg(OH)2↓ OH-+CO2=HCO3- 2Al(OH)3![]() Al2O3+3H2O 9b/17a×100% B A A
Al2O3+3H2O 9b/17a×100% B A A
【解析】考查元素及其化合物的性质,(1)根据硬铝中的成分,反应①的离子反应方程式为Mg+2H+=Mg2++H2↑、2Al+6H+=2Al3++3H2↑;因为反应①中加入过量的盐酸,因此反应②中离子反应是H++OH-=H2O,Mg2++2OH-=Mg(OH)2↓,氢氧化钠是过量的,因此有Al3++4OH-=AlO2-+2H2O;③利用碳酸的酸性强于偏铝酸,因此离子反应方程式为OH-+CO2=HCO3-,AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;④是氢氧化铝受热分解,其化学反应方程式为:2Al(OH)3![]() Al2O3+3H2O ;(2)根据(1)的分析,最后灼烧后的固体为氧化铝,因此根据铝元素守恒,样品中铝的质量为b×27×2/102g,则铝的质量分数为9b/17a×100%;(3)氢氧化钠量不足,Al元素不能全部转化成AlO2-,使得最后灼烧得到固体的质量减少,即测定结果偏低,故B正确;没有用蒸馏水洗涤,固体质量增加,即所测结果偏高,故A正确;不能充分灼烧,得到固体物质是氧化铝和氢氧化铝,所测结果偏高,故A正确。
Al2O3+3H2O ;(2)根据(1)的分析,最后灼烧后的固体为氧化铝,因此根据铝元素守恒,样品中铝的质量为b×27×2/102g,则铝的质量分数为9b/17a×100%;(3)氢氧化钠量不足,Al元素不能全部转化成AlO2-,使得最后灼烧得到固体的质量减少,即测定结果偏低,故B正确;没有用蒸馏水洗涤,固体质量增加,即所测结果偏高,故A正确;不能充分灼烧,得到固体物质是氧化铝和氢氧化铝,所测结果偏高,故A正确。