题目内容
1mol氧气在放电条件下,有30%转化为臭氧(O3),则放电后所得混合气体对氢气的相对密度是( )A.16
B.17.8
C.18.4
D.35.6
【答案】分析: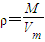 ,相同条件下,气体摩尔体积相同,所以不同气体的密度之比等于其摩尔质量之比,先根据转化关系计算混合气体的摩尔质量,再计算混合气体摩尔质量与氢气的摩尔质量之比.
,相同条件下,气体摩尔体积相同,所以不同气体的密度之比等于其摩尔质量之比,先根据转化关系计算混合气体的摩尔质量,再计算混合气体摩尔质量与氢气的摩尔质量之比.
解答:解:1 molO2有30%转化为臭氧(O3),发生反应的O2为1 mol×30%=0.3 mol.
由反应3O2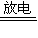 2O3知,生成的O3为0.2 mol,故反应后所得气体为0.2 mol O3和O2为(1-0.3)mol=0.7 mol,
2O3知,生成的O3为0.2 mol,故反应后所得气体为0.2 mol O3和O2为(1-0.3)mol=0.7 mol,
故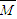 =
=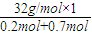 =35.6 g/mol,氢气的摩尔质量是2g/mol,混合气体的摩尔质量和氢气的摩尔质量之比等于其密度之比=35.6g/mol:2g/mol=17.8,故选B.
=35.6 g/mol,氢气的摩尔质量是2g/mol,混合气体的摩尔质量和氢气的摩尔质量之比等于其密度之比=35.6g/mol:2g/mol=17.8,故选B.
点评:本题考查物质的量的有关计算,明确“相同条件下不同气体的密度之比等于其摩尔质量之比”是解本题的关键,难度不大.
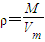 ,相同条件下,气体摩尔体积相同,所以不同气体的密度之比等于其摩尔质量之比,先根据转化关系计算混合气体的摩尔质量,再计算混合气体摩尔质量与氢气的摩尔质量之比.
,相同条件下,气体摩尔体积相同,所以不同气体的密度之比等于其摩尔质量之比,先根据转化关系计算混合气体的摩尔质量,再计算混合气体摩尔质量与氢气的摩尔质量之比.解答:解:1 molO2有30%转化为臭氧(O3),发生反应的O2为1 mol×30%=0.3 mol.
由反应3O2
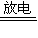 2O3知,生成的O3为0.2 mol,故反应后所得气体为0.2 mol O3和O2为(1-0.3)mol=0.7 mol,
2O3知,生成的O3为0.2 mol,故反应后所得气体为0.2 mol O3和O2为(1-0.3)mol=0.7 mol,故
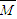 =
=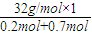 =35.6 g/mol,氢气的摩尔质量是2g/mol,混合气体的摩尔质量和氢气的摩尔质量之比等于其密度之比=35.6g/mol:2g/mol=17.8,故选B.
=35.6 g/mol,氢气的摩尔质量是2g/mol,混合气体的摩尔质量和氢气的摩尔质量之比等于其密度之比=35.6g/mol:2g/mol=17.8,故选B.点评:本题考查物质的量的有关计算,明确“相同条件下不同气体的密度之比等于其摩尔质量之比”是解本题的关键,难度不大.

练习册系列答案
相关题目

