题目内容
甲容器中发生了某化学反应,测得反应过程中,容器中存在Na+、H2O、CN-、ClO-、HCO3-、N2、Cl-七种粒子,其中ClO-和N2的物质的量随时间变化的曲线如图所示。根据题意完成下列填空:
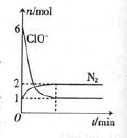
(1)CN一中氮元素的化合价是 。
(2)甲容器中发生反应的离子方程式是 。该反应的氧化产物是 (填化学式)。
(3)乙容器中用ClO2代替ClO-,溶液呈碱性,若最终两容器中N2的物质的量相同。则甲、乙两容器中参加反应的氧化剂的物质的量之比为 。
【答案】
(1)-3
(2)5ClO-+2CN-+H2O=N2↑+2HCO3-+5Cl-(写可逆符号也给分);N2、HCO3-
(3)5∶2(每空2分)
【解析】
试题分析:(1)非金属性C<N,所以氮元素的化合价是-3
(2)根据题意:5ClO-+2CN-+H2O=N2↑+2HCO3-+5Cl-(写可逆符号也给分);该反应的氧化产物是N2、HCO3-
(3)最终都被还原为Cl-,ClO2得5个电子,ClO-得2个电子,若最终两容器中N2的物质的量相同。则甲、乙两容器中参加反应的氧化剂的物质的量之比为5∶2。
考点:考察化合价确定、离子方程式、化学反应的计算。

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,E是过渡元素且为地壳中含量较多的金属元素之一.请回答下列问题:
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,E是过渡元素且为地壳中含量较多的金属元素之一.请回答下列问题:

 2C(g) △H<0。某研究小组进行了当其他条件不变时改变某一条件对上述反应影响的研究。下列关于图像的分析正确的是( )
2C(g) △H<0。某研究小组进行了当其他条件不变时改变某一条件对上述反应影响的研究。下列关于图像的分析正确的是( )
 2C(g) △H<0。某研究小组进行了当其他条件不变时改变某一条件对上述反应影响的研究。下列关于图像的分析正确的是( )
2C(g) △H<0。某研究小组进行了当其他条件不变时改变某一条件对上述反应影响的研究。下列关于图像的分析正确的是( )