题目内容
【题目】关于氨的下列叙述中,不正确的是( )
A.液氨是纯净物
B.实验室制氨气的方法是加热NH4Cl
C.氨易液化,因此可用来作制冷剂
D.氨极易溶于水,因此可用来作喷泉实验
【答案】B
【解析】
A.液氨即液态的氨,只含有氨分子一种分子,所以为纯净物,A项正确;
B.实验室制取氨气,可以采用NH4Cl与Ca(OH)2共热的方法;直接加热NH4Cl无法获得氨气,B项错误;
C.氨易液化,液氨变为气体会吸收大量的热,因此可用作制冷剂,C项正确;
D.由于氨极易溶于水,会使喷泉实验中的圆底烧瓶内的气压迅速减小,产生喷泉现象,D项正确;
答案选B

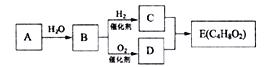
【题目】乙二醇(沸点:197.3℃)是一种重要的基础化工原料。由煤基合成气(主要成分CO、H2)与氧气先制备得到草酸二甲酯(沸点:164.5℃),再加氢间接合成乙二醇,具有反应条件温和、环境污染小等优点。反应过程如下:
反应I:4NO(g)+4CH3OH(g)+O2(g)![]() 4CH3ONO(g)+2H2O(g) △H1 =a kJ·mol-1
4CH3ONO(g)+2H2O(g) △H1 =a kJ·mol-1
反应II:2CO(g)+2CH3ONO(g)![]() CH3OOCCOOCH3(l)+2NO(g) △H2=b kJ·mol-1
CH3OOCCOOCH3(l)+2NO(g) △H2=b kJ·mol-1
反应III:CH3OOCCOOCH3(1)+4H2(g)![]() HOCH2CH2OH(1)+2CH3OH(g)△H3 =c kJ·mol-1
HOCH2CH2OH(1)+2CH3OH(g)△H3 =c kJ·mol-1
请回答下列问题:
(1)煤基合成气间接合成乙二醇的总热化学方程式是_____________________________,已知该反应在较低温条件下能自发进行。说明该反应的△H ______0(填“>”“<”或“=”)。
(2)CO、CH3ONO各0.4mol在恒温、容积恒定为2L的密闭容器中发生反应II,达到平衡时CO的体积分数与NO的体积分数相等,计算该反应的化学平衡常数K=_____________。若此时向容器中再通入0.4molNO,一段时间后,达到新平衡时NO的体积分数与原平衡时相比______(填“增大”“相等”“减小”或“不能确定”)。
(3)温度改变对反应II的催化剂活性有影响,评价催化剂的活性参数——空时收率和CO的选择性可表示如下:
空时收率=CH3OOCCOOCH3质量/反应时间×催化剂的体积
CO的选择性=合成[CH3OOCCOOCH3所消耗的CO的物质的量/反应掉的CO的物质的量]×100%
在不同温度下,某学习小组对四组其他条件都相同的反应物进行研究,经过相同时间th,测得空时收率、CO的选择性数据如下表所示。
反应温度(℃) | 空时收率(g·mL-1·h-1) | CO的选择性(%) |
130 | 0.70 | ①72.5 |
140 | 0.75 | ②71.0 |
150 | 0.71 | ③55.6 |
160 | 0.66 | ④63.3 |
下列说法正确的是________(填字母代号)。
A.温度升高,空时收率先增大后减小,说明△H2>0
B.温度升高,催化剂活性逐渐减弱,对CO的选择性逐渐降低
C.综合考虑空时收率和CO的选择性,工业生成CH3OOCCOOCH3时,选择140℃效果最好
D.130℃时,CO的选择性最高,说明CO生成CH3OOCCOOCH3的转化率最高
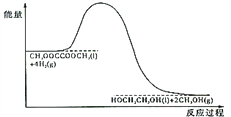
(4)120℃、常压时,CH3OOCCOOCH3+4H2![]() HOCH2CH2OH+2CH3OH反应过程中的能量变化如图所示。画出180℃、常压时,加入催化剂,该反应过程中的能量变化图。________
HOCH2CH2OH+2CH3OH反应过程中的能量变化如图所示。画出180℃、常压时,加入催化剂,该反应过程中的能量变化图。________
(5)研究证实,乙二醇、氧气可以在碱性溶液中形成燃料电池,负极的电极反应式是________________。