题目内容
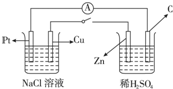
由铜片、锌片和100mL硫酸铜溶液组成的原电池工作一段时间后,铜片质量增加了12.8g,且溶液恰好变为无色.假设锌片上没有铜析出,试计算:
(1)锌片腐蚀后质量减轻了多少克?
(2)共有多少个电子流过外电路?
(3)原硫酸铜溶液的物质的量浓度是多少?
(1)锌片腐蚀后质量减轻了多少克?
(2)共有多少个电子流过外电路?
(3)原硫酸铜溶液的物质的量浓度是多少?
电极反应为Zn-2e-=Zn2+;铜做正极,溶液中铜离子得到电子生成铜发生还原反应,电极反应Cu2++2e-=Cu,铜片质量增加了12.8g,且溶液恰好变为无色.假设锌片上没有铜析出,说明溶液中铜离子全部析出,
(1)Zn-2e-=Zn2+;Cu2++2e-=Cu,铜片质量增加了12.8g,物质的量=
=0.2mol,依据电子守恒,Zn~Cu~2e-,溶解的锌质量=0.2mol×65g/mol=13g,
答:锌片腐蚀后质量减轻了13g;
(2)依据(1)计算可知转移电子总数为0.4mol,
答:反应过程中共有0.4mol电子转移;
(3)铜片质量增加了12.8g,且溶液恰好变为无色.假设锌片上没有铜析出,说明溶液中铜离子全部析出,原溶液中铜离子物质的量为0.2mol,溶液浓度=
=2mol/L,
答:原硫酸铜溶液的物质的量浓度为2mol/L.
(1)Zn-2e-=Zn2+;Cu2++2e-=Cu,铜片质量增加了12.8g,物质的量=
| 12.8g |
| 64g/mol |
答:锌片腐蚀后质量减轻了13g;
(2)依据(1)计算可知转移电子总数为0.4mol,
答:反应过程中共有0.4mol电子转移;
(3)铜片质量增加了12.8g,且溶液恰好变为无色.假设锌片上没有铜析出,说明溶液中铜离子全部析出,原溶液中铜离子物质的量为0.2mol,溶液浓度=
| 0.2mol |
| 0.1L |
答:原硫酸铜溶液的物质的量浓度为2mol/L.

练习册系列答案
相关题目