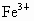��Ŀ����
������������ԭ��Ӧ����Fe+CuSO4�TCu+FeSO4 ��Cu+2FeCl3�TCuCl2+2FeCl2 ��2FeCl2+Cl2�T2FeCl3
����������Ӧ���жϸ�������������ǿ������˳����ȷ���ǣ�������
����������Ӧ���жϸ�������������ǿ������˳����ȷ���ǣ�������
����������������ԭ��Ӧ�к���Ԫ�ػ��ϼ۽��͵�����Ϊ��������������ԭ��Ӧ���������������Դ�����������������������
����⣺����CuԪ�صĻ��ϼ۽��ͣ���CuSO4Ϊ��������������Cu2+��Fe2+��
����FeԪ�صĻ��ϼ���+3�۽���Ϊ+2�ۣ���FeCl3Ϊ��������������Fe3+��Cu2+��
����ClԪ�صĻ��ϼ���0����Ϊ-1�ۣ���Cl2Ϊ��������������Cl2��Fe3+��
���������������ǿ������˳��ΪCl2��Fe3+��Cu2+��Fe2+��
��ѡA��
����FeԪ�صĻ��ϼ���+3�۽���Ϊ+2�ۣ���FeCl3Ϊ��������������Fe3+��Cu2+��
����ClԪ�صĻ��ϼ���0����Ϊ-1�ۣ���Cl2Ϊ��������������Cl2��Fe3+��
���������������ǿ������˳��ΪCl2��Fe3+��Cu2+��Fe2+��
��ѡA��
���������⿼�������ԵıȽϣ���ȷ������ԭ��Ӧ�����������жϼ������ԱȽϵĹ��ɼ��ɽ���ѶȲ���ע���˻���֪ʶ�Ŀ��飮

��ϰ��ϵ�д�
 �Ͻ�ƽ��У����ϵ�д�
�Ͻ�ƽ��У����ϵ�д�
�����Ŀ
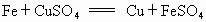
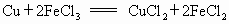
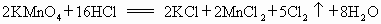
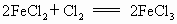
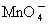 ��
�� ��
�� ��
��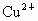 ��
��
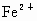 ��
��