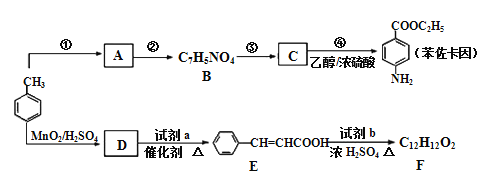
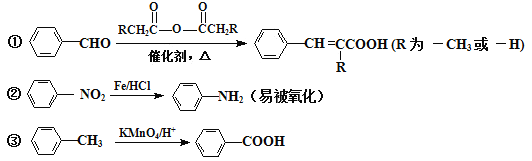
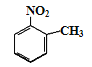
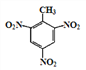
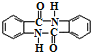
题目内容
【题目】用NA表示阿伏加德罗常数的值。下列叙述中一定正确的是
A. 一定条件下某密闭容器盛2 mol N2与3 mol H2反应生成的NH3分子数为2NA
B. 25 ℃时,Ksp(BaSO4)=1×10-10,则BaSO4饱和溶液中Ba2+数目为1×10-5NA
C. 一定条件下4.6g Na完全与O2反应生成7.2 g产物,失去的电子数为0.2NA
D. 1 L 0.1mol·L-1的NaHCO3溶液中HCO![]() 和CO
和CO![]() 的离子数之和为0.1NA
的离子数之和为0.1NA
【答案】C
【解析】A、合成氨是可逆反应,生成NH3物质的量小于2mol,故错误;B、没有告诉溶液的体积,无法计算Ba2+的物质的量,故错误;C、无论反应生成Na2O还是Na2O2,转移电子物质的量为4.6/23mol=0.2mol,故正确;D、碳元素存在形式:CO32-、HCO3-、H2CO3,根据物料守恒,即n(CO32-)+n(HCO3-)+n(H2CO3)=0.1mol,n(CO32-)+n(HCO3-)< 0.1mol,故错误。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目